
【题目】为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
A.NH3·H2OB.NaOHC.MgCO3D.Na2CO3
科目:高中化学 来源: 题型:
【题目】两种气态烃以一定比例混合,在105 ℃时,1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体的体积为11 L,下列各组混合烃中不符合此条件的是( )
A. C3H6、C4H10B. CH4、C3H4
C. C2H4、C4H10D. C3H8、C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】带有支链的烷烃A(MA=86)只有三种一氯取代产物B、C和D。B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B、D的进一步反应如图所示。
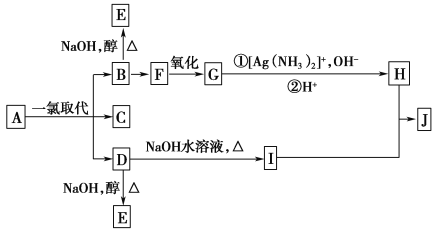
请回答:
(1)G的结构简式是________。
(2)B―→F的反应条件是_________________________________________。
(3)B转变为E的反应属于________(填反应类型名称)。
(4)F与I的关系是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是______(填“a”或“b”)电极。
②写出正极的电极反应式:_____________。
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) ![]() N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中![]() 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
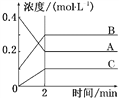
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
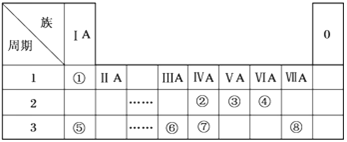
(1)在此元素周期表的一部分中,金属性最强的元素是__________(填元素符号)。
(2)⑤、⑥的原子半径由大到小的顺序为_______(填元素符号)。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________(填化学式)。
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
![]()
X溶液与Y溶液反应的离子方程式为______________,N→⑥的单质的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多钒酸盐在催化、医学等领域有着重要的应用。某多钒酸铵晶体的化学式为(NH4)xH6-xV10O28·10H2O。为测定其组成, 进行下列实验:
①称取样品0.9291 g,加入过量20% NaOH溶液,加热煮沸一段时间,生成的NH3用50.00 mL 0.1000 mol·L-1 盐酸吸收。加入指示剂,用0.1000 mol·L-1 NaOH标准溶液滴定剩余的HCl,终点时消耗NaOH标准溶液20.00 mL。
②另称取样品0. 9291 g,加过量1.5 mol·L-1 H2SO4,微热溶解。加入3 g NaHSO3,搅拌,使五价钒V10O286-完全转化为四价钒VO2+。加热煮沸一段时间,然后用0. 06000 mol·L-1 KMnO4标准溶液滴定(还原产物为Mn2+),终点时消耗KMnO4标准溶液25.00 mL。
(1)在实验②中,煮沸的目的是____。
(2)KMnO4滴定时,将VO2+氧化为五价的VO2+,该反应的离子方程式为____。
(3)根据实验结果,确定该多钒酸铵晶体的化学式。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com