
【题目】多钒酸盐在催化、医学等领域有着重要的应用。某多钒酸铵晶体的化学式为(NH4)xH6-xV10O28·10H2O。为测定其组成, 进行下列实验:
①称取样品0.9291 g,加入过量20% NaOH溶液,加热煮沸一段时间,生成的NH3用50.00 mL 0.1000 mol·L-1 盐酸吸收。加入指示剂,用0.1000 mol·L-1 NaOH标准溶液滴定剩余的HCl,终点时消耗NaOH标准溶液20.00 mL。
②另称取样品0. 9291 g,加过量1.5 mol·L-1 H2SO4,微热溶解。加入3 g NaHSO3,搅拌,使五价钒V10O286-完全转化为四价钒VO2+。加热煮沸一段时间,然后用0. 06000 mol·L-1 KMnO4标准溶液滴定(还原产物为Mn2+),终点时消耗KMnO4标准溶液25.00 mL。
(1)在实验②中,煮沸的目的是____。
(2)KMnO4滴定时,将VO2+氧化为五价的VO2+,该反应的离子方程式为____。
(3)根据实验结果,确定该多钒酸铵晶体的化学式。____
【答案】除去溶液中剩余的H2SO3(或SO2) 5VO2+ + MnO4- + H2O = 5VO2+ + Mn2+ + 2H+ (NH4)4H2V10O28·10H2O
【解析】
应用反应中的关系式计算NH4+、V10O286-的物质的量,再由两者的物质的量之比求出化学式中的x。
(1)实验②中H2SO4过量,3 g NaHSO3完全转化为H2SO3或SO2。五价钒V10O286-完全还原后剩余的H2SO3或SO2也能与KMnO4标准溶液反应。可见,煮沸的目的是除去溶液中剩余的H2SO3(或SO2)。
(2)实验②中反应在酸性溶液中进行,VO2+被氧化为五价的VO2+,MnO4- 被还原为 Mn2+ 。酸性溶液中可生成或消耗H+。由此可写出离子方程式5VO2+ + MnO4- + H2O = 5VO2+ + Mn2+ + 2H+ 。
(3)0.9291 g样品中的NH4+与吸收NH3的HCl的关系:NH4+ ~ NH3 ~ HCl。n(NH4+)=n(HCl)=50.00×10-3L ×0.1000 mol·L-1—20.00×10-3L×0.1000 mol·L-1 =3.000×10-3mol 。
0.9291 g样品中的V10O286-与KMnO4标准溶液的关系:V10O286-~ 10VO2+ ~ 2MnO4- 。 n(V10O286-)=![]() n(MnO4- )=
n(MnO4- )=![]() ×25.00×10-3L×0.06000 mol·L-1 =7.500×10-4mol 。
×25.00×10-3L×0.06000 mol·L-1 =7.500×10-4mol 。
据多钒酸铵晶体的化学式(NH4)xH6-xV10O28·10H2O,有n(NH4+)∶n(V10O286-)=x∶1,代入数据得x=4。该多钒酸铵晶体的化学式为(NH4)4H2V10O28·10H2O。


科目:高中化学 来源: 题型:
【题目】为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
A.NH3·H2OB.NaOHC.MgCO3D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:
xA(g)+yB(g)![]() pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
(1)反应2min内,vA=________________,vB=________________;
(2)化学方程式中,x=_____、y=_____、p=______、q=________;
(3)反应平衡时,D为2amol,则B的转化率为________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连成闭合回路,该装置在工作时,下列叙述中正确的是
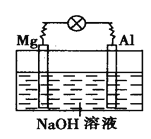
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____kJ·mol-1。
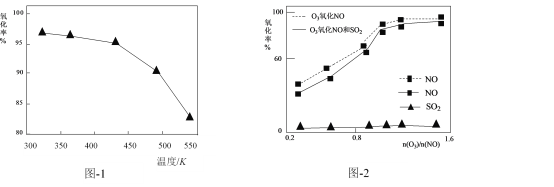
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____(填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,破坏的作用力相同的是
A.干冰升华和碘升华B.HCl溶于水和NaCl溶于水
C.石英熔化和冰熔化D.NH4Cl受热分解和HI受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com