
【题目】钛被称为继铁、铝之后的第三金属,回答下列问题:
(1)基态钛原子的价电子排布图为_________________,金属钛晶胞如图1所示,为________________堆积(填堆积方式)。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37 ℃,沸点为136 ℃,可知TiCl4为_______晶体。
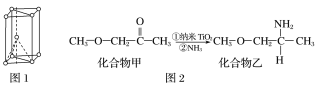
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是_________________________________。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________________。
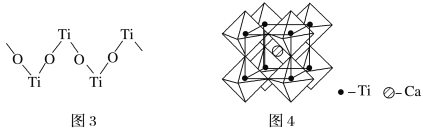
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为__________。
(5)钙钛矿晶体的结构如图4所示。钛离子位于立方晶胞的顶角,被________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被________个氧离子包围,钙钛矿晶体的化学式为________________。
【答案】![]() 六方最密 分子 化合物乙分子间形成氢键 N>O>C TiO2+(或[TiO]n2n+) 6 12 CaTiO3
六方最密 分子 化合物乙分子间形成氢键 N>O>C TiO2+(或[TiO]n2n+) 6 12 CaTiO3
【解析】
(1)Ti是22号元素,其3d、4s电子为其价电子;由金属钛晶胞结构分析钛原子的堆积方式;(2)根据TiCl4的熔、沸点分析晶体类型;(3)化合物乙含有N-H键,乙分子间可以形成氢键;化合物乙中采取sp3杂化的原子有C、N、O,同周期元素从左到右第一电离能逐渐增大,N原子2p轨道半充满为稳定结构,第一电离能大于O;(4)根据结构图,每个钛原子与2个氧原子成键、每个氧原子与2个钛原子成键,所以该离子中原子个数比为1:1;(5)根据图4,钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子。
(1)Ti是22号元素,其3d、4s电子为其价电子,其价电子排布图为![]() ;由金属钛晶胞结构可知,金属钛属于六方最密堆积;(2)TiCl4的熔、沸点较低,所以TiCl4属于分子晶体;(3)化合物乙含有N-H键,乙分子间可以形成氢键而甲不能,所以化合物乙的沸点明显高于化合物甲;化合物乙中采取sp3杂化的原子有C、N、O,同周期元素从左到右第一电离能逐渐增大,N原子2p轨道半充满为稳定结构,第一电离能大于O,故第一电离能由大到小的顺序为N>O>C;(4)根据结构图,每个钛原子与2个氧原子成键、每个氧原子与2个钛原子成键,所以该离子中原子个数比为1:1,该离子的化学式为[TiO]n2n+;(5)根据图4,钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子,根据均摊原则,晶胞在氧原子数是
;由金属钛晶胞结构可知,金属钛属于六方最密堆积;(2)TiCl4的熔、沸点较低,所以TiCl4属于分子晶体;(3)化合物乙含有N-H键,乙分子间可以形成氢键而甲不能,所以化合物乙的沸点明显高于化合物甲;化合物乙中采取sp3杂化的原子有C、N、O,同周期元素从左到右第一电离能逐渐增大,N原子2p轨道半充满为稳定结构,第一电离能大于O,故第一电离能由大到小的顺序为N>O>C;(4)根据结构图,每个钛原子与2个氧原子成键、每个氧原子与2个钛原子成键,所以该离子中原子个数比为1:1,该离子的化学式为[TiO]n2n+;(5)根据图4,钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子,根据均摊原则,晶胞在氧原子数是![]() 、钛原子数是
、钛原子数是![]() ,1个钙离子位于立方晶胞的体心,所以钙钛矿晶体的化学式为CaTiO3。
,1个钙离子位于立方晶胞的体心,所以钙钛矿晶体的化学式为CaTiO3。


科目:高中化学 来源: 题型:
【题目】根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气致使高速公路关闭,航班停飞,雾属于下列分散系中的
A. 溶液 B. 悬浊液 C. 乳浊液 D. 胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
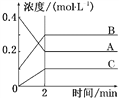
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体X投入过量的Y中,能生成蓝色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
A.Na和AlCl3溶液B.Al和NaOH溶液
C.Na2O2和CuSO4溶液D.Na和CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
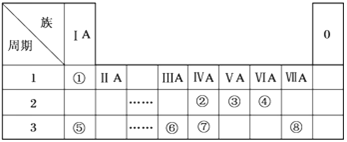
(1)在此元素周期表的一部分中,金属性最强的元素是__________(填元素符号)。
(2)⑤、⑥的原子半径由大到小的顺序为_______(填元素符号)。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________(填化学式)。
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
![]()
X溶液与Y溶液反应的离子方程式为______________,N→⑥的单质的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某气态烷烃和烯烃(含一个双键)的混合气体2.24 L完全燃烧后,将产生的气体缓慢通过浓硫酸,浓硫酸增重4.05 g,剩余气体通过碱石灰,碱石灰增重6.60 g。另再取2.24 L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05 g。
(1)确定混合气体由哪两种烃组成_______。
(2)计算混合气体中两种烃的体积分数_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化,不能通过一步化学反应完成的是
A.CO2→H2CO3B.SiO2→H2SiO3 C.Na2O2→Na2CO3D.SiO2→Na2SiO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com