
【题目】将固体X投入过量的Y中,能生成蓝色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
A.Na和AlCl3溶液B.Al和NaOH溶液
C.Na2O2和CuSO4溶液D.Na和CuSO4溶液
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】某液态烃的分子式为CmHn,相对分子质量为H2的39倍。它不能使酸性KMnO4溶液和溴的四氯化碳溶液褪色。在催化剂存在时,7.8 g该烃能与0.3 mol H2发生加成反应生成相应的饱和烃CmHp。则:
(1)m、n、p的值分别是m=____,n=____,p=____。
(2)CmHp的结构简式是_____________。
(3)CmHn能与浓硫酸、浓硝酸的混合酸反应,该反应的化学方程式是_______,该反应属于___反应,有机产物的名称是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,下列说法正确的是
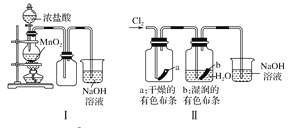
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B. Ⅱ图中:湿润的有色布条能褪色,烧杯NaOH溶液的作用是吸收尾气
C. Ⅲ图中:生成蓝色的烟
D. Ⅳ图中:量筒中发生了加成反应,量筒内液面上升,量筒壁上有无色液滴出现
查看答案和解析>>
科目:高中化学 来源: 题型:
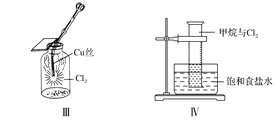
【题目】钛被称为继铁、铝之后的第三金属,回答下列问题:
(1)基态钛原子的价电子排布图为_________________,金属钛晶胞如图1所示,为________________堆积(填堆积方式)。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37 ℃,沸点为136 ℃,可知TiCl4为_______晶体。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是_________________________________。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________________。
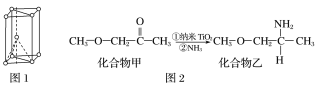
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为__________。
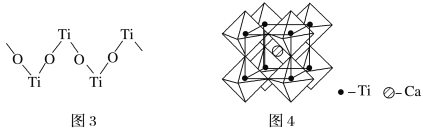
(5)钙钛矿晶体的结构如图4所示。钛离子位于立方晶胞的顶角,被________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被________个氧离子包围,钙钛矿晶体的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个装有CH4和Cl2 混合气体的集气瓶,用玻璃片盖好瓶口后,分别作如下处理,各有怎样的现象发生?
(1)①置于黑暗中: _____________________;
②将点燃的镁条靠近集气瓶外壁: ________________________;
③放在有光线的房子里: __________________________________。
(2)CH4和Cl2发生的一系列反应都是___________(填反应类型)反应,请写出CH4和Cl2反应生成一氯甲烷的化学方程式: ________________________________。
(3)若要使0.5 mol CH4完全和Cl2发生取代反应,并生成相同物质的量的四种取代产物,则生成HCl的物质的量为_________。
A.2.5mol B.2mol C.1.25mol D.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中发生反应2A(g)+B(g)![]() 2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A. 等于10 s B. 等于12 s
C. 大于12 s D. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从工业含锌废渣(主要成分为ZnO,还含有SiO2、Fe3+、Cu2+、Pb2+等杂质)制取ZnCO32Zn(OH)2的一种工艺如下:
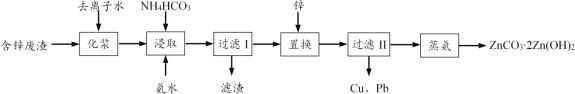
(1)浸取前,需将含锌废渣粉碎并加水制成悬浊液(化浆),目的是____。
(2)浸取时的温度控制在30 ℃,原因是____。浸取后,ZnO转化为[Zn(NH3)4]CO3溶液,滤渣的主要成分为____。
(3)除Cu2+、Pb2+时,也可加入(NH4)2S使其生成硫化物沉淀。已知Ksp(CuS)=6.310-36,Ksp(PbS)=8.010-28,要使溶液中Cu2+、Pb2+的浓度均小于1.010-5 mol·L-1,则沉淀时需控制S2-的浓度至少为_____mol·L-1。
(4)蒸氨时发生反应的化学方程式为____。
(5)本工艺中可循环利用的物质为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示:
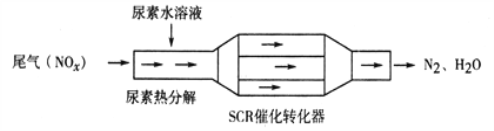
下列说法不正确的是( )
A. 尿素水溶液热分解反应不属于氧化还原反应
B. 转化器工作过程中,当转移0.6mol电子时,会消耗4.48L NH3
C. 该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
D. 转化NO2过程的化学方程式为:8NH3+6NO2![]() 2N2+12H2O
2N2+12H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com