
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | 由水电离出的H+浓度为1×10-12molL-1 | NH4+、Na+、NO3-、Cl- | 一定能大量共存 NH4++H2ONH3H2O+H+ |
C | pH=1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D
【答案】C
【解析】
A.滴加氨水能发生反应:Al3++3NH3![]() H2O=Al(OH)3↓+3NH4+,Al3+不能大量共存,离子方程式错误,A项错误;
H2O=Al(OH)3↓+3NH4+,Al3+不能大量共存,离子方程式错误,A项错误;
B.常温下纯水中水电离出的H+浓度为10-7mol/L,而该溶液中水电离出的H+浓度为1×10-12mol/L<1×10-7mol/L,说明该溶液中水的电离被抑制,该溶液可能是酸溶液或碱溶液,若是碱溶液有反应:NH4++OH-= NH3![]() H2O,离子方程式错误,B项错误;
H2O,离子方程式错误,B项错误;
C.酸性溶液中有反应:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,Fe2+和MnO4-不能大量共存,离子方程式正确,C项正确;
D.SO2具有强还原性,ClO-具有强氧化性,发生反应:SO2+ClO-+H2O=SO42-+Cl-+2H+,离子方程式错误,D项错误;答案选C。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】两种气态烃以一定比例混合,在105 ℃时,1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体的体积为11 L,下列各组混合烃中不符合此条件的是( )
A. C3H6、C4H10B. CH4、C3H4
C. C2H4、C4H10D. C3H8、C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气致使高速公路关闭,航班停飞,雾属于下列分散系中的
A. 溶液 B. 悬浊液 C. 乳浊液 D. 胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C﹣C单键可以绕键轴旋转,某烃结构简式可表示为![]() ,下列说法中正确的是
,下列说法中正确的是
A. 分子中至少有9个碳原子处于同一平面上
B. 该烃的一氯代物只有一种
C. 分子中至少有10个碳原子处于同一平面上
D. 该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是
A. 苯的硝化反应的化学方程式:![]() +HO-NO2
+HO-NO2![]()
![]() +H2O
+H2O
B. 电解饱和氯化铜溶液(惰性电极)的阳极反应式:Cu2++2e-=Cu
C. 打磨过的镁条与热水反应的离子反应式:Mg+2H+=Mg2++H2↑
D. 燃煤烟气用氨水法脱硫的化学反应式:4NH3·H20+2SO2+O2=2(NH4)2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】带有支链的烷烃A(MA=86)只有三种一氯取代产物B、C和D。B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B、D的进一步反应如图所示。
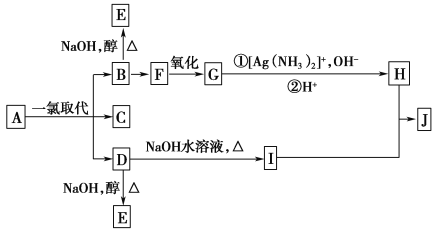
请回答:
(1)G的结构简式是________。
(2)B―→F的反应条件是_________________________________________。
(3)B转变为E的反应属于________(填反应类型名称)。
(4)F与I的关系是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
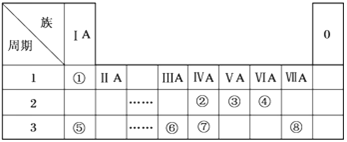
(1)在此元素周期表的一部分中,金属性最强的元素是__________(填元素符号)。
(2)⑤、⑥的原子半径由大到小的顺序为_______(填元素符号)。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________(填化学式)。
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
![]()
X溶液与Y溶液反应的离子方程式为______________,N→⑥的单质的化学方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com