
【题目】下列说法不正确的是( )
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.用排饱和氯化铵溶液的方法收集氨气
C.金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火
D.在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液颜色从橙色变成黄色
【答案】B
【解析】
A. 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗,均符合仪器的结构和操作规范,故A正确;
B. 氨气极易溶于水,在饱和氯化铵溶液中溶解度仍然较大,故B错误;
C. 金属着火时,可用细沙覆盖灭火,将金属与空气隔开;电器设备引起的火灾,不可用泡沫灭火器灭火,防止触电,引起安全事故,故C正确;
D. 在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,Cr2O72-+H2O![]() CrO42-+2H+,平衡正向移动,溶液颜色从橙色变成黄色,故D正确;
CrO42-+2H+,平衡正向移动,溶液颜色从橙色变成黄色,故D正确;
故选B。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
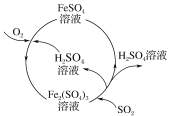
A.该过程中可得到化工产品H2SO4
B.该工艺流程是除去煤燃烧时产生的SO2
C.该过程中化合价发生改变的元素只有Fe和S
D.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01mol·L1 KMnO4溶液,几滴浓H2SO4 | 2mL0.3mol·L1H2C2O4 溶液 | 2 | 褪为无色 |
b | 4mL0.01mol·L1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:_____________。
(2)实验I试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:________。
(3)瑛瑛和超超查阅资料,实验I试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验III | 实验IV | ||
实验操作 |
|
|
|
实验现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
实验IV的目的是:_______________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72- 浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i.MnO2与H2C2O4反应生成了Mn2+。
过程ii.__________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001molMnO2加入到6mL____________中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到_______________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A.钠与水反应:2Na+H2O=2Na++OH-+H2↑
B.NO2溶于水:3NO2+H2O=2H++2![]() +NO
+NO
C.向氢氧化钡溶液中滴加稀硫酸:Ba2++![]() +OH-+H+=BaSO4↓+H2O
+OH-+H+=BaSO4↓+H2O
D.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=![]() +4
+4![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是________(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
Ⅱ.常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示:
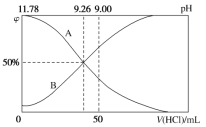
(3)根据图象回答下列问题。
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B”)。
②NH3·H2O的电离常数为______________。
③当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=______ mol·L-1(用数字计算式表示)。
Ⅲ.已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(4)称取2.000 g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有________。
(5)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为____________。终点时消耗标准溶液25mL,硝酸银样品纯度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高化合价与最低化合价之和为2。回答下列问题:
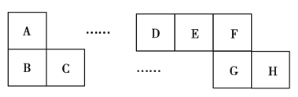
(1)D元素在周期表中的位置为___。
(2)B、E、F的简单离子半径由大到小的顺序为__(用离子符号表示)。
(3)上述元素所形成的气态单质中能用于饮用水消毒的有__(填化学式)。
(4)B的单质在F的单质中燃烧的火焰颜色为__。
(5)C元素的单质可以在D和F形成的一种气态化合物中燃烧,写出该反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
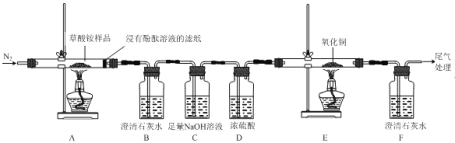
(1)实验证明草酸铵分解产物有:NH3、CO2、CO和水,其中说明分解产物中有CO的实验现象是__。
(2)装置C中发生反应的离子方程式为_____。
Ⅱ.该同学利用草酸铵测定某品牌牛奶中钙的含量,实验步骤如下:
①取100 mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.100mol·L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗KMnO4溶液16.00mL。
已知:H++![]() +H2C2O4——Mn2++CO2+H2O(未配平)
+H2C2O4——Mn2++CO2+H2O(未配平)
(3)计算该品牌牛奶中钙的含量(单位:g·L-1),写出计算过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.202×l05Pa),但它在180℃即开始升华。
(1)氯化铝是____________。(填“离子化合物”或“共价化合物”)
(2)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L-1,试确定氯化铝在蒸气状态时的化学式为____________。
(3)无水氯化铝在空气中强烈的“发烟”,其原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com