
【题目】A~H八种短周期主族元素在周期表中的相对位置如图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高化合价与最低化合价之和为2。回答下列问题:
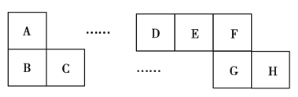
(1)D元素在周期表中的位置为___。
(2)B、E、F的简单离子半径由大到小的顺序为__(用离子符号表示)。
(3)上述元素所形成的气态单质中能用于饮用水消毒的有__(填化学式)。
(4)B的单质在F的单质中燃烧的火焰颜色为__。
(5)C元素的单质可以在D和F形成的一种气态化合物中燃烧,写出该反应的化学方程式:__。
【答案】第2周期ⅣA族 N3->O2->Na+ Cl2、O3 黄色 2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】
根据元素在周期表中的位置及元素性质分析元素的种类;根据元素周期律及元素性质分析解答。
C的单质为“国防金属”,因此C为![]() ,以此为突破口可推知A为
,以此为突破口可推知A为![]() ,B为
,B为![]() ;由“E的最高化合价与最低化合价之和为2”可知E为
;由“E的最高化合价与最低化合价之和为2”可知E为![]() ,故D为C,F为
,故D为C,F为![]() ,G为
,G为![]() ,H为
,H为![]() 。则
。则
(1)碳在元素周期表中位于第2周期ⅣA族,故答案为:第2周期ⅣA族;
(2)电子层结构相同的微粒,核电荷数越大,离子半径越小,故离子半径:![]() ,故答案为:N3->O2->Na+;
,故答案为:N3->O2->Na+;
(3)Cl2溶解于水生成![]() ,能杀菌消毒;O3具有强氧化性,能杀菌消毒,故答案为:Cl2、O3;
,能杀菌消毒;O3具有强氧化性,能杀菌消毒,故答案为:Cl2、O3;
(4)Na在氧气中燃烧产生黄色火焰,故答案为:黄色;
(5)镁在二氧化碳中燃烧生成氧化镁和碳,化学方程式为:2Mg+CO2![]() 2MgO+C,故答案为:2Mg+CO2
2MgO+C,故答案为:2Mg+CO2![]() 2MgO+C。
2MgO+C。


科目:高中化学 来源: 题型:
【题目】已知H+可以写成H3O+,从某些性质看,NH3和H2O,![]() 和H3O+,OH-和
和H3O+,OH-和![]() ,N3-和O2-两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
,N3-和O2-两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
①2Na+2NH3=2NaNH2+H2↑
②CaO+2NH4Cl=CaCl2+2NH3↑+H2O
③3Mg(NH2)2=Mg3N2+4NH3↑
④NH4Cl+NaNH2=NaCl+2NH3↑
A.①B.②④C.全部D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据系统命名法,天然橡胶应称为聚2 甲基1,3 丁二烯,其结构简式为![]() ,单体为2 甲基1, 3 丁二烯。该反应的化学方程式为n
,单体为2 甲基1, 3 丁二烯。该反应的化学方程式为n![]()
![]()
![]() 。合成橡胶就是根据以上原理制成的。
。合成橡胶就是根据以上原理制成的。
(1)以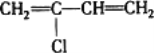 为单体可生成氯丁橡胶,试写出该反应的化学方程式:________。
为单体可生成氯丁橡胶,试写出该反应的化学方程式:________。
(2)CH2=CHCl 与聚苯乙烯的单体在一定条件下可发生加聚反应,所得产物的结构简式为________。(只需写一种产物即可)
(3)某高聚物的结构简式如下:
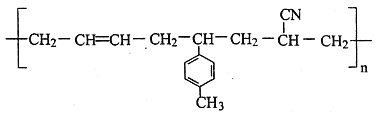
则形成该高分子化合物的单体的结构简式分别为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.用排饱和氯化铵溶液的方法收集氨气
C.金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火
D.在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液颜色从橙色变成黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作 | 结论 |
A | 向甲苯中滴加少量高锰酸钾溶液,高锰酸钾溶液褪色 | 甲苯发生了氧化反应 |
B | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀生成 | 蛋白质发生了变性 |
C | 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀 | 该溶液中含有 |
D | 向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制的Cu(OH)2悬浊液,加热,没有观察到砖红色沉淀 | 淀粉没有水解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1~20号元素中![]() 、
、![]() 、
、![]() 、
、![]() 四种元素原子的质子数大小顺序为
四种元素原子的质子数大小顺序为![]() ;
;![]() 元素原子的最外层电子数是次外层电子数的2倍;
元素原子的最外层电子数是次外层电子数的2倍;![]() 元素原子的
元素原子的![]() 层电子数是
层电子数是![]() 层电子数的一半;
层电子数的一半;![]() 元素原子的次外层电子数比最外层电子数多1;
元素原子的次外层电子数比最外层电子数多1;![]() 元素原子的
元素原子的![]() 层、
层、![]() 层电子数之和等于
层电子数之和等于![]() 层、
层、![]() 层电子数之和。试推断:
层电子数之和。试推断:
(1)元素的名称:![]() ______,
______,![]() ______。
______。
(2)原子结构示意图:![]() ______,
______,![]() ______。
______。
(3)实验室制取![]() 的单质的化学方程式为______。
的单质的化学方程式为______。
(4)若没有“质子数大小顺序为![]() ”的限制,
”的限制,![]() 还可以是______元素。
还可以是______元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________,已知:K(300℃)>K(350℃),该反应是________反应(填“放热”或“吸热”)。
(2)下图中表示NO2的变化的曲线是___,用O2的浓度变化表示从0~2 s内该反应的平均速率v=__________。

(3)能说明该反应已经达到平衡状态的是(____)
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(____)
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸钠被列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。如图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程简图:
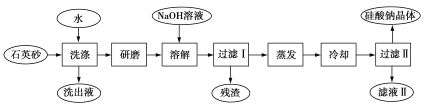
(1)要将洗出液中的溶质析出,采用的方法是蒸发结晶,则蒸发时用到的主要仪器有______。
(2)图中加入NaOH溶液,发生反应的离子方程式为______。
(3)洗涤石英砂的目的是______,过滤Ⅰ所得残渣为______(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com