
【题目】卤素有多种可变化合价,可组成多种含氧酸盐,这些盐的命名和卤素的化合价有关,如次卤酸盐(含XO-)、卤酸盐(XO3-)、高卤酸盐(XO4-)等,有一种碘和氧的化合物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是( )
A.I2O4B.I3O5C.I4O7D.I4O9
科目:高中化学 来源: 题型:
【题目】FeCl3,又名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_______________________。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质 ⑦易溶于水物质
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_______mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =_______mol/L.
(3)将饱和FeCl3溶液逐滴加入沸水中,继续煮沸可制取氢氧化铁胶体,氢氧化铁胶体可处理污水,该反应的化学方程式为__________________;高铁酸钠Na2FeO4是一种新型水处理剂,用FeCl3制备的离子方程式如下,请完成该方程式的配平:___Fe3++_____Cl 2+_____OH-=_____FeO42-+_____Cl-+_____H2O
(4)FeCl3还可用于有机物的鉴别,已知芳香族化合物A、B、C的分子式均为C7H8O
A | B | C | |
加入氯化铁溶液 | 显紫色 | 无明显现象 | 无明显现象 |
加入钠 | 放出氢气 | 放出氢气 | 不反应 |
苯环上一氯代物的种数 | 2 | 3 | 3 |
则B的结构简式为____,A与浓溴水反应的方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(关系图中“—”相连的两种物质能发生反应)。下列判断正确的是
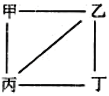
A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 四种原子中,Y原子半径最小 D. W的简单阴离子可能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是:( )
A. 元素周期表有8个主族
B. ⅠA族的元素全部是金属元素
C. 元素周期表有7个周期
D. 短周期是指第一、二周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,未来理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适当的催化剂使之水解成葡萄糖,再将葡萄糖转化成乙醇(葡萄糖在酒化酶的作用下可转化成乙醇和二氧化碳),用作燃料。
(1)请写出将绿色植物的秸秆转化为乙醇两步反应的化学方程式。
(2)现有1620t含纤维素约为50%的秸秆,理论上可制得80%的酒精多少吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )
A.煤经过气化和液化两个物理变化,可变为清洁能源
B.汽车尾气的大量排放影响了空气的质量,是造成PM2.5值升高的原因之一
C.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
D.糖类、油脂和蛋白质都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOx)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)①NH3催化氧化可制备硝酸。
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3=________________。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如下图所示。则p1________p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是______________________________。

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为P2MPa。则500℃时该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
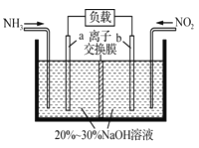
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_________________,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为____________mol。
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
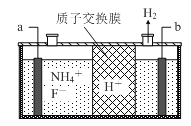
①a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:_____________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_____________________。
②已知氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,则NH4F的电子式为_____________,0.1mol/LNH4F溶液中所有离子浓度由大到小的顺序为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
B. 如图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则HB是强酸
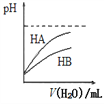
C. 25℃时,pH=2的1.0 L醋酸溶液中水电离出的H+的数目为10-12NA
D. 某吸热反应能自发进行,则该反应一定是熵增的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日前正在研发的两种由电化学制取氨的装置如图1和图2所示:

下列说法正确的是
A. 工作时,O2-向X极移动,H+向Z极移动
B. 两个电解池的电解总反应方程式完全相同
C. 两个电解池生成相同量NH3时,电路中流过电子的物质的量相同
D. 随着反应的进行,两种电解池中电解质不断减少,需及时补充电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com