
【题目】柠檬酸是常用除水垢剂,可从柠檬中提取。柠檬酸由C、H和O三种元素组成,其分子结构如图所示。有关说法不正确的是( )

A.柠檬酸溶液可以和水垢中Mg(OH)2和CaCO3反应
B.在加热和浓硫酸条件下,柠檬酸可与CH3CH2OH反应
C.在加热和浓硫酸条件下,柠檬酸可与CH3COOH反应
D.在加热和镍催化条件下,柠檬酸可以和H2反应
【答案】D
【解析】
由图中柠檬酸的球棍模型可知其结构简式为:![]() ,分子中含有3个羧基和一个羟基,再进行解题。
,分子中含有3个羧基和一个羟基,再进行解题。
A.由分析可知,柠檬酸中含有羧基即有类似于醋酸的性质,故柠檬酸溶液可以和水垢中Mg(OH)2和CaCO3反应,A正确;
B.由分析可知,柠檬酸中含有羧基即有类似于醋酸的性质,故在加热和浓硫酸条件下,柠檬酸可与CH3CH2OH发生酯化反应,B正确;
C.由分析可知,柠檬酸中含有羟基即有类似于乙醇的性质,故在加热和浓硫酸条件下,柠檬酸可与CH3COOH发生酯化反应,C正确;
D.由于柠檬酸分子中只有羧基上的碳氧双键,没有其它不饱和键,故在加热和镍催化条件下,柠檬酸不能和H2反应,D错误;
故答案为:D。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】(11分)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。已知:
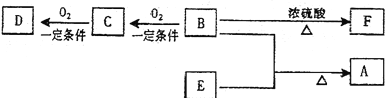
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是: 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式:
。
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2—甲基—1—丙醇和甲酸在一定条件下制取E。该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(s)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A.v(C)=0.02mol·(L·s)-1B.v(B)=0.06mol·(L·min)-1
C.v(A)=1.5mol·(L·min)-1D.v(D)=0.01mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是( )
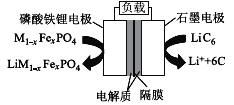
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验现象所进行的解释不合理的是( )
选项 | 现象和事实 | 解释 |
A | 乙烯通入溴的四氯化碳溶液,溴的四氯化碳溶液橙红色褪色 | 乙烯和四氯化碳溶液中的溴发生加成反应,生成无色的1,2-二溴乙烷 |
B | 海轮船壳外侧焊接大量锌块,能有效减缓钢铁船壳在海水中的腐蚀速率 | 锌和铁在海水中构成原电池,锌作负极提供电子,从而保护了钢铁 |
C | 将大理石颗粒加入盐酸中,反应生成气体的速率先逐渐加快后逐渐减慢 | 开始阶段反应放热,溶液温度升高;后期反应吸热,溶液温度下降 |
D | 在AgNO3溶液中加入过量NaCl溶液,静置后,在上层清液中仍检测到Ag+ | Ag+和Cl-的沉淀反应为可逆反应,受反应限度制约,Ag+不能完全沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca3N2是重要的化学试剂,易潮解、被氧化,实验室用N2和金属钙在加热条件下制备Ca3N2的装置如图所示(已知:钙能在CO2中燃烧)。请回答下列问题:
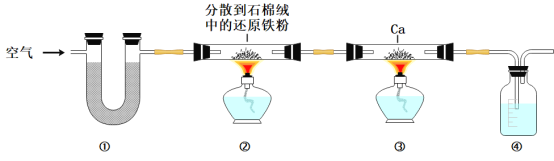
(1)Ca3N2中所含化学键的类型为____________。
A.离子键 B.共价键 C.氢键
(2)装置①中的U型管中的物质为___________,其作用为________________。
(3)装置②的作用为___________________________。
(4)组装好仪器,装入药品,通入空气后,应先点燃____________处酒精灯,再点燃另一个酒精灯。
(5)写出Ca3N2潮解时的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为 ______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液 ______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

①亚磷酸属于 ______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)= ______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为 ______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:

①试剂X为 ______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH ______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) H<0。
2SO3(g) H<0。
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:_______。
(2)某兴趣小组在实验室对该反应进行研究,在一密闭容器内加入一定量的SO2和O2,部分实验图像如图1

① 该反应的平衡常数表达式为___________________。
② t1、t2、t3中,达到化学平衡状态的是________________。
③ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________________。
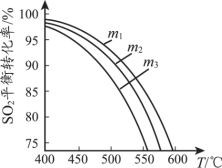
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m[m=n(SO2)/n(O2)] 不同时,SO2的平衡转化率与温度(T)的关系如图所示,则m1、m2、m3的从大到小的顺序为___________________。
(4)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH-)=_______mol·L1。将原料气SO2和O2通入该氨水中,当c(OH-)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=____。
)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
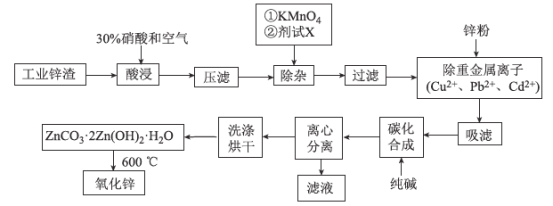
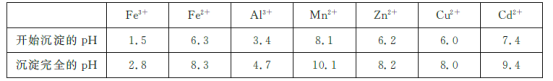
已知:相关金属离子[c(Mn+)=0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5 mol/L左右。写出一种加快锌渣浸出的方法:_____________________________________
(2)为调节溶液的pH,则试剂X为________(填化学式),且调节溶液pH的范围是________。
(3)除杂时加入高锰酸钾的作用是___________,发生反应的离子方程式为_______________。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:_________________________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com