
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
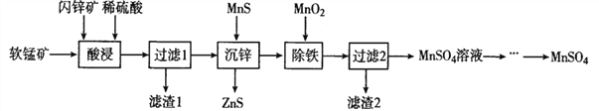
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为______________________。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为___________________。
(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是________________。(写化学式)
(5)该工艺流程中可以循环利用的物质是____________________。
【答案】催化剂 4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O 1.25×109 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Fe(OH)3 ZnS
【解析】
(1)因为软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS),加稀硫酸会把这些金属氧化物变成离子, “酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是催化剂的作用,因为催化剂能够改变化学反应的速。MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O。本题答案:催化剂 4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=c(Mn2+)/c(Zn2+)。Ksp(ZuS)= c(Zn2+).c(S2-)
ZnS+Mn2+(aq),该反应的平衡常数K=c(Mn2+)/c(Zn2+)。Ksp(ZuS)= c(Zn2+).c(S2-)
Ksp(MnS)=c(c(Mn2+). c(S2-), Ksp(MnS)/ Ksp(MnS)= c(Mn2+)/c(Zn2+)=K所以K=1.25×109
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(4)由(3)知强酸性条件下加入MnO2氧化Fe2+ 变成Fe3+ ,, Ksp(Fe(OH)3)=2.6![]() 10-39“调节pH约为3~4时会出现Fe(OH)3沉淀。本题答案:Fe(OH)3。(写化学式)
10-39“调节pH约为3~4时会出现Fe(OH)3沉淀。本题答案:Fe(OH)3。(写化学式)
(5)由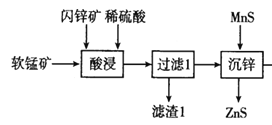 知该工艺流程中可以循环利用的物质是ZnS。
知该工艺流程中可以循环利用的物质是ZnS。


科目:高中化学 来源: 题型:
【题目】黑火药是我国古代的四大发明之一,距今已有1000多年的历史。黑火药爆炸的反应为2KNO3+3C+S=K2S+N2↑+3CO2↑,则该反应中的还原产物是( )
A.CO2B.N2和CO2C.K2S和N2D.S和KNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,Na+的物质的量浓度最大的是( )
A. 1 mL 0.5 mol·L-1的NaNO3溶液 B. 100 mL 0.01 mol·L-1的NaCl溶液
C. 100 mL 0.1 mol·L-1的NaOH溶液 D. 10 mL 0.1 mol·L-1的Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示,根据图中数据填空:
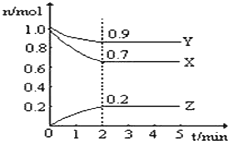
(1)该反应的化学方程式为______________________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为__________;
(3)平衡时容器内混合气体密度比起始时________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时_________;
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是_________。
2HI(g)达到平衡状态的是_________。
(2)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以某种比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是
A. CH4、C2H4 B. CH4、C3H6 C. C2H4、C3H4 D. C2H2、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。

③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
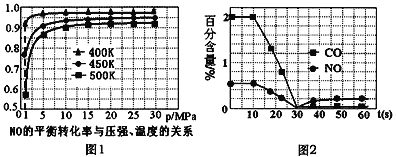
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。
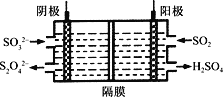
(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com