
【题目】下列溶液中,Na+的物质的量浓度最大的是( )
A. 1 mL 0.5 mol·L-1的NaNO3溶液 B. 100 mL 0.01 mol·L-1的NaCl溶液
C. 100 mL 0.1 mol·L-1的NaOH溶液 D. 10 mL 0.1 mol·L-1的Na2SO4溶液
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,可逆反应N2 + 3H2![]() 2NH3 达到平衡状态的标志是
2NH3 达到平衡状态的标志是
A. N2、H2、NH3在容器中共存
B. 混合气体的总物质的量不再发生变化
C. 单位时间内生成n mol N2,同时生成3n mol H2
D. 单位时间内消耗n mol N2,同时消耗n mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)![]() 2B(g)+C (g),下列能说明反应已达平衡状态的是
2B(g)+C (g),下列能说明反应已达平衡状态的是
A. 混合气体的密度保持不变 B. 容器内B、C的浓度之比为2∶1
C. B的生成速率等于C的消耗速率 D. 气体的体积分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
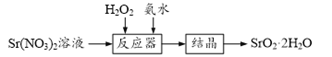
反应原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3,该反应放热。
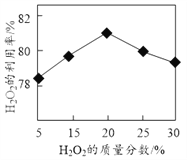
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比20%的H2O2的利用率低的原因是______。
(2)SrO2·2H2O与CO2会反应变质,反应的化学方程式为______。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F-、CO32-的溶液中,当c(Sr2+)=0.0010 mol·L-1时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=______。[已知25℃时:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9]
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 mol·L-1 Na2S2O3标准液滴定到蓝色恰好消失时,共消耗标准液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程________。(已知:S2O32-![]() S4O62-)
S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO + H2O2= Ca(HCOO)2+ 2H2O + H2↑实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)反应温度最好控制_______________(A.60℃左右 B. 200左右 C. 400℃左右),原因是_____________。
(2)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 ____________________________。
(3)实验时需强力搅拌45min,其目的是_________________。
(4)结束后需调节溶液呈碱性,其目的是__________________________。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
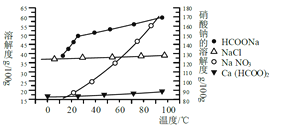
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 1 | 3. 2 |
Al3+ | 3. 0 | 5. 0 |
Fe2+ | 5. 8 | 8. 8 |
请补充完整由碳酸钙制备甲酸钙晶体的实验方案:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用,用__________溶解碳酸钙样品,调整溶液pH为5,过滤后,将滤液与甲酸钠溶液混合,调整溶液为碱性;充分搅拌,所得溶液经__________、___________洗涤干燥得甲酸钙晶体。(提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入等物质的量的A 和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:

下列说法中正确的是
A. 30 min~40 min 之间该反应使用了催化剂
B. 反应方程式中的x=2,正反应为吸热反应
C. 30 min 时条件的变化是降低压强,40 min 时条件的变化是升高温度
D. 前20 min A 的平均反应速率为0.08 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
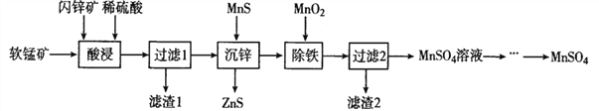
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为______________________。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为___________________。
(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是________________。(写化学式)
(5)该工艺流程中可以循环利用的物质是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g) ![]() pC(g),△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g),△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
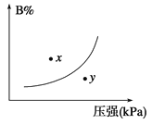
①m+n < p②x点表示的正反应速率大于逆反应速率③n < p④x点反应速率比y点时的反应速率慢⑤若升高温度,该反应的平衡常数增大
A. ②③④B. ①②④
C. ③④⑤D. ①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com