
【题目】反应mA(s)+nB(g) ![]() pC(g),△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g),△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
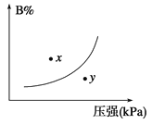
①m+n < p②x点表示的正反应速率大于逆反应速率③n < p④x点反应速率比y点时的反应速率慢⑤若升高温度,该反应的平衡常数增大
A. ②③④B. ①②④
C. ③④⑤D. ①③⑤
科目:高中化学 来源: 题型:
【题目】在四川抗震救灾中,芦山县一存放漂白粉的仓库因漏雨而引发爆炸,冒出大量有毒的浓烟,周围的居民被迅速疏散。下列关于漂白粉的叙述不正确的是( )
A.漂白粉是由氯气通氢氧化钠溶液中制得的
B.漂白粉要密封保存在干燥处
C.漂白粉可用于杀菌消毒
D.漂白粉的主要成分是次氯酸钙和氯化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,Na+的物质的量浓度最大的是( )
A. 1 mL 0.5 mol·L-1的NaNO3溶液 B. 100 mL 0.01 mol·L-1的NaCl溶液
C. 100 mL 0.1 mol·L-1的NaOH溶液 D. 10 mL 0.1 mol·L-1的Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示,根据图中数据填空:
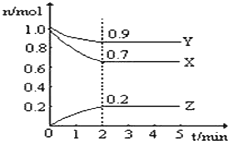
(1)该反应的化学方程式为______________________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为__________;
(3)平衡时容器内混合气体密度比起始时________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时_________;
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是_________。
2HI(g)达到平衡状态的是_________。
(2)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图。

(1)该反应的化学方程式为 (反应物或生成物用符号X、Y表示): _________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是________________。
Ⅱ.(3)如图是可逆反应X2+3Y2 ![]() 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是______。
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是______。
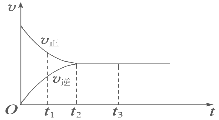
A. t1时,只有正方向反应
B. t2时,反应达到限度
C. t2~t3,反应不再发生
D. t2~t3,各物质的浓度不再发生变化
Ⅲ. 以下是关于化学反应2SO2+O2![]() 2SO3的两个素材:
2SO3的两个素材:
素材1:某温度和压强下,2L容器中,不同时间点测得密闭体系中三种物质的物质的量
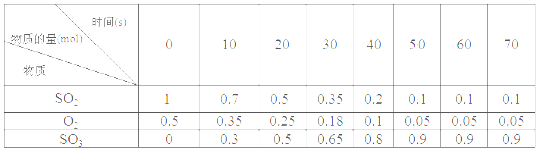
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)

根据以上的两个素材回答问题:
(4)根据素材1中计算20~30 s期间,用二氧化硫表示的化学反应平均速率为________。
(5)根据素材2中分析得到,提高该化学反应限度的途径有_______________。
(6)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应具体条件是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以某种比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是
A. CH4、C2H4 B. CH4、C3H6 C. C2H4、C3H4 D. C2H2、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子核磁共振谱(PMR)是研究有机物结构的重要方法之一。在研究的化合物分子中:所处环境完全相同的氢原子在PMR谱中出现同一种信号峰:如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。又如CH3-CHBr=CHX存在着如下的两种不同空间结构:
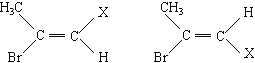
因此CH3-CHBr=CHX的PMR谱上会出现氢原子的四种不同信号峰。
请填写下列空白:
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该有机物质结构式可能为:____________________、____________________;
(2)测定CH3CH=CHCl时:能得到氢原子给出的信号峰6种:由此可推断该有机物一定存在______种不同的结构:其结构式为:_________________、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其 周期数相同;B的价电子排布式为nsnnpn+2;C、D为同周期元素,C是同周期元素中离子半径最小的元素,D元素最外层有一个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ED4溶液的方法制备纳米材料。
回答下列问题:
(1)D原子的价电子排布图为___________,E原子核外有_____个未成对电子,五种元素中电负性最大的是___________(填元素符号)。
(2)化合物D2B的中心原子的杂化方式为______________,它的VSEPR模型名称____________,分子的立体构型为_____________。
(3)与分子晶体D2B3互为等电子体的一种分子为____________(填化学式)。
(4)由A、B、D三种元素所形成的一系列化合物中氧化性最强的是_______(填化学式,下同),酸性最强的是_________________。
(5)单质B有两种同素异形体,其中沸点高的是______(填分子式),原因是__________。
(6)C与D能形成化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的化学式为____________________。
(7)E单质有两种同素异形体,高温下是体心立方堆积,但在常温下的晶体结构为如图所示的六方最密堆积。已知晶胞参数分别为acm和ccm,则该晶体的密度可表示为______g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
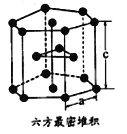 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com