
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其 周期数相同;B的价电子排布式为nsnnpn+2;C、D为同周期元素,C是同周期元素中离子半径最小的元素,D元素最外层有一个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ED4溶液的方法制备纳米材料。
回答下列问题:
(1)D原子的价电子排布图为___________,E原子核外有_____个未成对电子,五种元素中电负性最大的是___________(填元素符号)。
(2)化合物D2B的中心原子的杂化方式为______________,它的VSEPR模型名称____________,分子的立体构型为_____________。
(3)与分子晶体D2B3互为等电子体的一种分子为____________(填化学式)。
(4)由A、B、D三种元素所形成的一系列化合物中氧化性最强的是_______(填化学式,下同),酸性最强的是_________________。
(5)单质B有两种同素异形体,其中沸点高的是______(填分子式),原因是__________。
(6)C与D能形成化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的化学式为____________________。
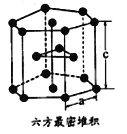
(7)E单质有两种同素异形体,高温下是体心立方堆积,但在常温下的晶体结构为如图所示的六方最密堆积。已知晶胞参数分别为acm和ccm,则该晶体的密度可表示为______g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
 。
。
【答案】![]() 2Osp3杂化正四面体V形CCl4HClOHClO4O3相对分子质量越大,熔沸点越高Al2Cl6
2Osp3杂化正四面体V形CCl4HClOHClO4O3相对分子质量越大,熔沸点越高Al2Cl6![]()
【解析】
A、B、C、D、E为原子序数依次增大的五种前四周期元素。B的价电子排布式为nsnnpn+2,s轨道最多可以排布2个电子,所以n=2,则B的价电子排布式为2s22p4,即B为O元素;A的核外电子总数与其周期数相同且原子序数小于B,则A为氢元素;C、D为同周期元素,C是同周期元素中离子半径最小的元素,则C为铝元素;D元素最外层有一个未成对电子,则D为氯元素;E位于元素周期表的第四周期第IVB族,则E为Ti元素。
(1)D为17号的氯元素,原子的价电子排布图为![]() ,E为Ti元素,基态原子电子排布式为1s22s22p63s23p63d24s2,原子核外有2个未成对电子。元素非金属性越强电负性越大,则五种元素中电负性最大的是O;
,E为Ti元素,基态原子电子排布式为1s22s22p63s23p63d24s2,原子核外有2个未成对电子。元素非金属性越强电负性越大,则五种元素中电负性最大的是O;
(2)化合物D2B为Cl2O,中心原子O原子和氯原子形成2个σ键,孤电子对个数=![]() ×(6-2×1)=2,价层电子对数为=2+2=4,为sp3杂化,故其VSEPR模型为正四面体,含2对孤电子对,分子立体构型为V形;
×(6-2×1)=2,价层电子对数为=2+2=4,为sp3杂化,故其VSEPR模型为正四面体,含2对孤电子对,分子立体构型为V形;
(3)等电子体是指价电子数和原子数相同的分子、离子或原子团。与分子晶体D2B3互为等电子体的一种分子为CCl4;
(4)由A、B、D三种元素所形成的一系列化合物HClO4、HClO3、HClO2、HClO中氧化性最强的是HClO,酸性最强的是HClO4;
(5)单质B有两种同素异形体,其中沸点高的是O3,原因是结构相似的分子晶体中相对分子质量越大,熔沸点越高;
(6)C与D能形成化合物Q。根据铝和氯的化合价可设Q为(AlCl3) n,在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则M=![]() , 则133.5n=267,解得n=2,此时Q的化学式为Al2Cl6;
, 则133.5n=267,解得n=2,此时Q的化学式为Al2Cl6;
(7)在常温下的晶体结构为如图所示的六方最密堆积,根据均摊法可知含有钛原子个数为12![]() 。已知晶胞参数分别为acm和ccm,则晶胞的底面积为
。已知晶胞参数分别为acm和ccm,则晶胞的底面积为![]() ,体积为
,体积为![]() ,该晶体的密度可表示为
,该晶体的密度可表示为![]() =
=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g) ![]() pC(g),△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g),△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
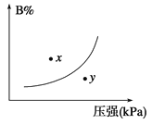
①m+n < p②x点表示的正反应速率大于逆反应速率③n < p④x点反应速率比y点时的反应速率慢⑤若升高温度,该反应的平衡常数增大
A. ②③④B. ①②④
C. ③④⑤D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol.试回答:
(1)烃A的分子式为__________.
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则燃烧时消耗标准状况下的氧气____________L.
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为_____________.
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式有三种,它们分别为________、________、_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
![]()
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:
![]()
(1)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_______________。
②A溶液一步转化为C溶液的反应离子方程式为________________。
(2)若X是一种黄绿色的气体,Y的饱和溶液滴入沸水中能生成红褐色胶体。
①检验溶液Z是否变质最灵敏的一种试剂是____________________(名称);
②一定条件下W与水反应的化学方程式_______________________________。
(3)X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法____________________,X转化为Y的化学方程式为______________________;
(4)X为一元强碱溶液,W是形成酸雨的主要气体。
①则Y到Z的离子方程式为________________________________________;
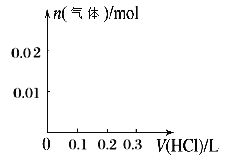
②请画出向含0.01molX和0.01molY的溶液中逐滴加入0.1mol/L稀盐酸的体积和生成气体的物质的量的关系的图像___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
B. 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合: Al3++2SO42-+2Ba2++4OH- =2BaSO4+AlO2-+ 2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H+ +2I-=2Fe2+ +I2 +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)VO43-的中心原子价层孤电子对数目为______,一个VO43-离子中含有_______个σ键;
(3)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
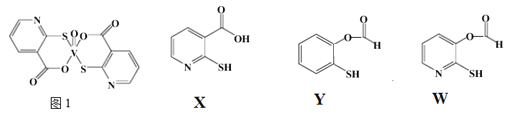
①该药物中N原子的杂化方式是_______;
②X、Y、W三种物质在水中的溶解性由大到小的顺序为________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]()
![]() 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]()
![]() 。
。
③下列微粒中存在“离域Π键”的是_____;
A.O3 B.SO42- C.H2S D.NO3-
④CS2分子中大π键可以表示为_______________;
(4)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(5)某六方硫钒化合物晶体的晶胞如图4所示(![]() 表示V,
表示V,![]() 表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
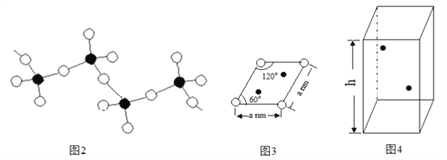
①请在图4中用![]() 标出V原子的位置;
标出V原子的位置;
②已知晶胞的密度为dg/cm3 ,计算晶胞参数h =_____________cm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 用酒精作为萃取剂从溴水中提取溴
B. 分液时,下层液体下端流出,上层液体上口倒出
C. 蒸馏时,温度计的水银球应位于蒸馏烧瓶的支管口附近
D. 过滤时,漏斗的下端要紧靠烧杯的内壁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com