
(1)ФЪ·ҙУҰA(g)Ј«3B(g)=2C(g)ЦРЈ¬ИфТФОпЦКAұнКҫөДёГ·ҙУҰөД»ҜС§·ҙУҰЛЩВКОӘ0.2 molЎӨLЈӯ1ЎӨminЈӯ1Ј¬ФтТФОпЦКBұнКҫҙЛ·ҙУҰөД»ҜС§·ҙУҰЛЩВКОӘ________molЎӨLЈӯ1ЎӨminЈӯ1ЎЈ
(2)ФЪ2 LөДГЬұХИЭЖчЦРЈ¬ідИл2 mol N2әН3 mol H2Ј¬ФЪТ»¶ЁМхјюПВ·ўЙъ·ҙУҰЈ¬3 sәуІвөГN2ОӘ1.9 molЈ¬ФтТФH2өДЕЁ¶Иұд»ҜұнКҫөД·ҙУҰЛЩВКОӘ________________ЎЈ
(3)Ҫ«10 mol AәН5 mol B·ЕИлИЭ»эОӘ10 LөДГЬұХИЭЖчЦРЈ¬ДіОВ¶ИПВ·ўЙъ·ҙУҰЈә3A(g)Ј«B(g)??2C(g)Ј¬ФЪЧоіх2 sДЪЈ¬ПыәДAөДЖҪҫщЛЩВКОӘ0.06 molЎӨLЈӯ1ЎӨsЈӯ1Ј¬ФтФЪ2 sКұЈ¬ИЭЖчЦРУР________mol AЈ¬ҙЛКұCөДОпЦКөДБҝЕЁ¶ИОӘ______ЎЈ

| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәМоҝХМв
ФЪТ»ёц№М¶ЁМе»эөДГЬұХИЭЖчЦРЈ¬ПтИЭЖчЦРідИл2 mol A әН1 mol BЈ¬·ўЙъИзПВ·ҙУҰЈә2A(g) Ј« B(g)  3C(g) Ј« D(s)Ј¬·ҙУҰҙпөҪЖҪәвКұCөДЕЁ¶ИОӘ1.2 mol/L.
3C(g) Ј« D(s)Ј¬·ҙУҰҙпөҪЖҪәвКұCөДЕЁ¶ИОӘ1.2 mol/L.
ЈЁ1Ј©ИфК№ИЭЖчОВ¶ИЙэёЯЈ¬ЖҪәвКұ»мәПЖшМеөДЖҪҫщПа¶ФДҰ¶ыЦКБҝјхРЎЈ¬ФтХэ·ҙУҰОӘ________ЈЁМоЎ°ОьИИЎұ»тЎ°·ЕИИЎұЈ©·ҙУҰЈ®
ЈЁ2Ј©ИфО¬іЦИЭЖчМе»эәНОВ¶ИІ»ұдЈ¬°ҙПВБР·Ҫ·ЁјУИлЖрКјОпЦКЈ¬ҙпөҪЖҪәвКұCөДЕЁ¶ИИФОӘ1.2 mol/LөДКЗ______ЈЁУГРтәЕМоҝХЈ©Ј®
ўЩ4 mol AЈ«2 mol BЎЎўЪ3 mol CЈ«1 mol DЈ«l mol B
ўЫ3 mol CЈ«2 mol DЎЎўЬ1.6 mol AЈ«0.8 mol BЈ«0.6 mol C
ЈЁ3Ј©ДіОВ¶ИПВЈ¬ПтИЭЖчЦРјУИл3 mol CәН0.8 mol DЈ¬·ҙУҰҙпөҪЖҪәвКұCөДЕЁ¶ИИФОӘ1.2 mol/LЈ¬ФтИЭЖчөДИЭ»эVУҰҙуУЪ________LЈ¬РЎУЪ________L.
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәјЖЛгМв
ФЪТ»¶ЁМхјюПВЈ¬ФЪИЭ»эОӘ2LөДГЬұХИЭЖчЦРЈ¬Ҫ«2molЖшМеMәН3molЖшМеN»мәПЈ¬·ўЙъИзПВ·ҙУҰЈә2M(g)+ 3N(g)  x Q(g)+3R(g)Ј¬ҫӯ2minҙпЖҪәвЈ¬ЙъіЙ2.4molRЈ¬ІўІвөГQөДЕЁ¶ИОӘ0.4mol/LЎЈЗуЈә
x Q(g)+3R(g)Ј¬ҫӯ2minҙпЖҪәвЈ¬ЙъіЙ2.4molRЈ¬ІўІвөГQөДЕЁ¶ИОӘ0.4mol/LЎЈЗуЈә
ЈЁ1Ј©УГЖшМеMАҙұнКҫёГ·ҙУҰөД»ҜС§·ҙУҰЛЩВККЗ¶аЙЩЈҝ
ЈЁ2Ј©·ҙУҰЗ°әуөДС№ЗҝұИКЗ¶аЙЩЈҝ
ЈЁ3Ј©NөДЧӘ»ҜВККЗ¶аЙЩЈҝ
ЈЁ4Ј©ЖҪәвКұЖшМеQЛщХјөДМе»э·ЦКэОӘ¶аЙЩЈҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәјЖЛгМв
ЈЁ4·ЦЈ©ФЪТ»№М¶ЁИЭ»эөДГЬұХИЭЖчЦРЈ¬a mol/LN2әНb mol/L H2·ҙУҰЈ¬Т»¶ЁМхјюПВҫӯ№э2minҙпөҪЖҪәвЈ¬ЙъіЙc mol/L NH3Ј®
ЗуЈәЈЁ1Ј©УГH2ұнКҫөДЛЩВККЗ¶аЙЩЈҝЈЁ2Ј©N2өДЧӘ»ҜВККЗ¶аЙЩЈҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәјЖЛгМв
Т»¶ЁМхјюПВЈ¬ҝЙДж·ҙУҰЈәA2+B2 2CҙпөҪЖҪәвЎЈҫӯІв¶ЁЈ¬ЖҪәвКұc(A2)=0.5mol/LЈ¬c(B2)=0.1mol/LЈ¬c(C)=1.6mol/LЈ¬ИфA2ЎўB2әНCөДЖрКјЕЁ¶И·ЦұрОӘamol/LЈ¬bmol/LЈ¬cmol/LЎЈ
2CҙпөҪЖҪәвЎЈҫӯІв¶ЁЈ¬ЖҪәвКұc(A2)=0.5mol/LЈ¬c(B2)=0.1mol/LЈ¬c(C)=1.6mol/LЈ¬ИфA2ЎўB2әНCөДЖрКјЕЁ¶И·ЦұрОӘamol/LЈ¬bmol/LЈ¬cmol/LЎЈ
Зл»ШҙрЈә
ЈЁ1Ј©aЎўbУҰВъЧгөД№ШПөКЗ ЈЁ2Ј©aөДИЎЦө·¶О§КЗ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәјЖЛгМв
Т»¶ЁОВ¶ИПВөДГЬұХИЭЖчЦРҙжФЪИзПВ·ҙУҰЈәCO(g)+H2O(g)  CO2(g)+H2(g)Ј¬ТСЦӘCOЈЁgЈ©әНH2O(g)өДЖрКјЕЁ¶ИҫщОӘ2molЎӨL-1Ј¬ҫӯІв¶ЁёГ·ҙУҰФЪёГОВ¶ИПВөДЖҪәвіЈКэK=1Ј¬КФЕР¶ПЈә
CO2(g)+H2(g)Ј¬ТСЦӘCOЈЁgЈ©әНH2O(g)өДЖрКјЕЁ¶ИҫщОӘ2molЎӨL-1Ј¬ҫӯІв¶ЁёГ·ҙУҰФЪёГОВ¶ИПВөДЖҪәвіЈКэK=1Ј¬КФЕР¶ПЈә
(1)өұCOЧӘ»ҜВКОӘ25%КұЈ¬ёГ·ҙУҰКЗ·сҙпөҪЖҪәвЈ¬ИфОҙҙпөҪЈ¬ПтДДёц·ҪПтҪшРРЈҝ
(2)ҙпөҪЖҪәвКұЈ¬COөДЧӘ»ҜВКОӘ¶аЙЩЈҝ
(3)өұCOөДЖрКјЕЁ¶ИИФОӘ2molЎӨL-1Ј¬H2O(g)өДЖрКјЕЁ¶ИОӘ6molЎӨL-1Ј¬ЗуЖҪәвКұCOөДЧӘ»ҜВКЈҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәјЖЛгМв
ДіРЎЧйАыУГH2C2O4ИЬТәәНЛбРФKMnO4ИЬТә·ҙУҰАҙМҪҫҝЎ°Мхјю¶Ф»ҜС§·ҙУҰЛЩВКөДУ°ПмЎұЎЈКөСйКұЈ¬ПИ·ЦұрБҝИЎБҪЦЦИЬТәЈ¬И»әуө№ИлКФ№ЬЦРСёЛЩХсөҙ»мәПҫщФИЈ¬ҝӘКјјЖКұЈ¬НЁ№эІв¶ЁНКЙ«ЛщРиКұјдАҙЕР¶П·ҙУҰөДҝмВэЎЈёГРЎЧйЙијЖБЛИзПВөД·Ҫ°ёЎЈ
| ұаәЕ | H2C2O4ИЬТә | ЛбРФKMnO4ИЬТә | ОВ¶И/Ўж | ||
| ЕЁ¶И/ mol?LЈӯ1 | Ме»э/mL | ЕЁ¶И/ mol?LЈӯ1 | Ме»э/mL | ||
| ўЩ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ўЪ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ўЫ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |

Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәКөСйМв
°ұ»щјЧЛбп§ЈЁNH2COONH4Ј©КЗТ»ЦЦ°ЧЙ«№ММеЈ¬ТЧ·ЦҪвЎўТЧЛ®ҪвЈ¬ҝЙУГЧц·КБПЎўГр»рјБЎўПҙөУјБөИЎЈДі»ҜС§РЛИӨРЎЧйДЈДвЦЖұё°ұ»щјЧЛбп§Ј¬ІўМҪҫҝЖд·ЦҪв·ҙУҰЖҪәвіЈКэЎЈ·ҙУҰөД»ҜС§·ҪіМКҪЈә 2NH3(g)Ј«CO2(g) NH2COONH4(s)ЎЈЗл°ҙТӘЗу»ШҙрПВБРОКМвЈә
NH2COONH4(s)ЎЈЗл°ҙТӘЗу»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ЗлФЪПВНј1·ҪҝтДЪ»ӯіцУГЕЁ°ұЛ®УлЙъКҜ»ТЦЖИЎ°ұЖшөДЧ°ЦГјтНјЎЈ
ЈЁ2Ј©ЦЖұё°ұ»щјЧЛбп§өДЧ°ЦГИзПВНј2ЛщКҫЎЈЙъіЙөД°ұ»щјЧЛбп§РЎҫ§МеРьёЎФЪЛДВИ»ҜМјЦРЎЈ
ўЩҙУ·ҙУҰәуөД»мәПОпЦР·ЦАліцІъЖ·өДКөСй·Ҫ·ЁКЗ_____________ЈЁМоІЩЧчГыіЖЈ©ЎЈ
ўЪЙПНј3ЦРЕЁБтЛбөДЧчУГКЗ_______________________________________ЎЈ
ЈЁ3Ј©Ҫ«Т»¶ЁБҝҙҝҫ»өД°ұ»щјЧЛб粒ММеЦГУЪМШЦЖөДГЬұХХжҝХИЭЖчЦРЈЁјЩЙиИЭЖчМе»эІ»ұдЈ¬№ММеКФСщМе»э
әцВФІ»јЖЈ©Ј¬ФЪәг¶ЁОВ¶ИПВК№ЖдҙпөҪ·ЦҪвЖҪәвЎЈКөСйІвөГІ»Н¬ОВ¶ИПВөДЖҪәвКэҫЭБРУЪПВұнЈә
| ОВ¶И(Ўж) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ЖҪәвЧЬС№Зҝ(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ЖҪәвЖшМеЧЬЕЁ¶И(ЎБ10Јӯ3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
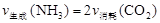
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com