
【题目】随原子序数递增,x、y、z、……等八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如下图所示。

下列说法正确的是
A. x元素在周期表中的位置是第二周期ⅠA族
B. 离子半径:g2->h->d2->e+>f3+
C. 最高价氧化物对应水化物的酸性:y>z
D. 气态氢化物的热稳定性:g>h
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】溴化钙是一种重要的化工原料,制备CaBr2·2H2O 的主要流程如下:
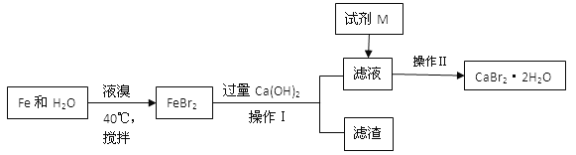
下列说法不正确的是
A. 试剂M 是HBr,加入HBr的目的是除去过量的Ca(OH)2
B. 操作I为过滤,滤渣为Fe、Fe(OH)2和Fe(OH)3;操作Ⅱ为重结晶,具体操作步骤为蒸发浓缩、冷却结晶、洗涤、干燥
C. 制得的CaBr2·2H2O 可以通过以下方法测定纯度:称取一定量的样品溶于水,滴入足量Na2CO3 溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,计算便得出CaBr2·2H2O的纯度
D. 工业上也可以将氨气通入石灰乳,并加入溴,于65℃进行反应,制得溴化钙,此反应中还会生成一种无色气体,该反应的化学方程式为3Ca(OH)2+3Br2+2NH3 ![]() 3CaBr2+N2+6H2O
3CaBr2+N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属及其化合物的说法正确的是( )
A. 俗语“真金不怕火炼”说明某些金属在高温的条件下也不与氧气发生反应
B. Na2O为淡黄色固体,MgO为白色固体
C. 铁不与冷、热水反应,高温下也不与水蒸气发生反应
D. 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列各小题中的问题(NA用6.02![]() 1023mol-1来计算)
1023mol-1来计算)
(1)1.806×1023个KClO3中K+和ClO3-的物质的量之比为______。
(2)0.1molNa2SO4中约含有_________个Na+。
(3)与34gNH3含有相同原子数的H2O的物质的量为:_______________。
(4)32gCH4中含有________mol质子。
(5)1.806×1023个H2SO4中含氧原子的物质的量为________mol。
(6)1个氧原子质量为ag,则1mol O的质量为______g。
(7)2gH2与1molSO2原子数目之比:_______________。
(8)在标准状况下,与1.7gNH3含有相同原子数的CO的体积为:_______________。
(9)在标准状况下,在1.12LCH4含有相同原子数的H2O分子的个数为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,①和②为两个体积相同的固定容器,图中“![]() ”和“
”和“![]() ”分别表示氢原子和氧原子,则下列说法正确的是( )
”分别表示氢原子和氧原子,则下列说法正确的是( )
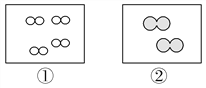
A. 若①中的H2为1 mol,则②中所含原子总数为3.01×1023个
B. ①和②中气体的质量之比为1∶8
C. H2、O2均能发生化合反应,但不能发生置换反应
D. 两容器的温度和压强均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、油脂、蛋白质的叙述正确的是
A. 油脂都不能使溴水褪色
B. 食物中含有的纤维素,可在人体内直接水解成葡萄糖
C. 糖类、油脂、蛋白质在一定条件下均可发生水解反应
D. 棉麻、蚕丝织品可通过灼烧时产生的气味来进行鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫、氮单质及其化合物的叙述正确的是
A. SO2、NO2均为酸性氧化物
B. “雷雨肥庄稼”与氮的固定有关
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. 铜片与稀盐酸不反应,向溶液中通入NO2后,铜片质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6mol·L-1硫酸、6mol·L-1盐酸和蒸馏水)

回答下列问题:
(1)装置A中发生反应的化学方程式是______________________________________。
(2)装置B的作用是_______________________,装置C的作用是___________________。
(3)装置D中发生反应的化学方程式是______________________________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2放电,2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为________g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________L。
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应容器中,充分加热后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为多少?(写出计算过程)___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com