
下表中各原子的核外电子层排布是否正确,如不正确,简要说明原因.

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省八县市一中高二下学期期末联考化学试卷(带解析) 题型:填空题
下表为周期表的一部分,其中的编号代表对应位置的元素。
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | | | | | | | | | | | | ⑦ | | | | ⑧ | |
| | | | | | ⑨ | | | | | ⑩ | | | | | | | |

查看答案和解析>>
科目:高中化学 来源:2013届福建省八县市高二下学期期末联考化学试卷(解析版) 题型:填空题
下表为周期表的一部分,其中的编号代表对应位置的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
⑨ |
|
|
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)写出上表中元素⑨原子的核外电子排布式 。
(2)元素④、⑤的第一电离能大小顺序是: > ;(用元素符号表示,下同)元素⑥、⑧电负性大小顺序是: >
(3)元素③、⑧形成的化合物中心原子杂化轨道类型: ,分子的空间构型
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢
氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程式
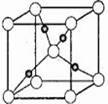
(5)下图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为 。
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。
已知NF3与NH3的结构类似,但NF3 不易与Cu2+形成配离子,其主要原因是:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省八县(市)一中联考高二(下)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com