
【题目】减少CO2的排放以及CO2的资源化利用具有重要意义。
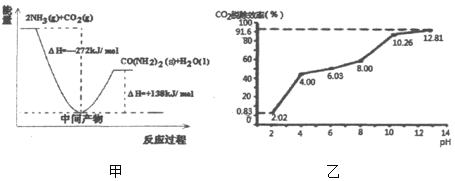
(1)H2NCOONH4是工业合成尿素[CO(NH2)2]的中间产物,该反应的能量变化示意图如图甲所示,用CO2和氨气合成尿素的热化学方程式为_____。
(2)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一。
①写出氨水捕集烟气中的CO2生成碳酸氢铵的主要化学方程式_____。
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图乙所示,烟气中CO2的含量为12%,烟气通入氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为_____(精确到0.01)。
③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是_____。
(3)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为2H2(g)+CO(g)CH3OH(g)△H=﹣90kJ/mol.在T1℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应过程如下图所示。
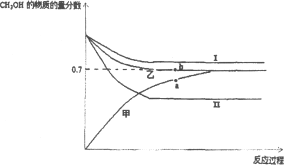
容器 | 甲 | 乙 | 丙 |
起始反应物投入量 | 2molH2、1molCO | 1molCH3OH | 2mol CH3OH |
①能代表丙反应的曲线是_____(选填I、II),a、b点的压强关系为Pa_____Pb(填>、<、=),理由是_____。
②b点时反应吸收的能量为_____kJ。
【答案】CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)△H=﹣134kJ/mol CO2+NH3·H2O=NH4HCO3 0.13mol 碳酸氢铵受热易分解生成CO2 I > 平衡时a点甲醇的物质的量分数小,则总物质的量大 11.25
【解析】
(1)由图可知放热为(272kJ﹣138kJ)=134kJ,则CO2和氨气合成尿素的热化学方程式为CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol;(2)①氨水捕集烟气中的CO2生成碳酸氢铵,化学方程式为CO2+NH3·H2O=NH4HCO3;②由图可知,pH为12.81的氨水吸收烟气时脱除的CO2的效率为91.6%,设脱除的CO2的物质的量最多为x,由CO2+NH3·H2O=NH4HCO3可知,![]() ,解得x=0.13mol;③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成CO2;(3)①由表格数据可知,均极限转化为甲醇时,甲、乙中起始量相同,丙中最大,且图中曲线I平衡时甲醇含量大,则能代表丙反应的曲线是I;物质的量越大、压强越大,2H2(g)+CO(g)CH3OH(g)为气体体积减小的反应,a点甲醇的物质的量分数小,则总物质的量大,即Pa>Pb;②b点时甲醇物质的量分数为0.7,则
,解得x=0.13mol;③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成CO2;(3)①由表格数据可知,均极限转化为甲醇时,甲、乙中起始量相同,丙中最大,且图中曲线I平衡时甲醇含量大,则能代表丙反应的曲线是I;物质的量越大、压强越大,2H2(g)+CO(g)CH3OH(g)为气体体积减小的反应,a点甲醇的物质的量分数小,则总物质的量大,即Pa>Pb;②b点时甲醇物质的量分数为0.7,则
CH3OH(g)2H2(g)+CO(g)△H=+90kJ/mol
起始量(mol) 1 0 0
转化量(mol) x 2x x
平衡量(mol) 1﹣x 2x x
![]() ,解得x=1/8mol,可知b点时反应吸收的能量为1/8mol×90kJ/mol=11.25kJ。
,解得x=1/8mol,可知b点时反应吸收的能量为1/8mol×90kJ/mol=11.25kJ。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】无论以何种比例混合的10mL混和气,在50mL的氧气中燃烧生成CO2和液态的H2O,燃烧后所得气体的体积为35mL,则该混合物可能为
A. C3H6 C4H6 B. C2H6 C3H6
C. C2H4 C3H8 D. C2H2 C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用废旧聚乳酸材料制备乳酸铝,方案如下:

己知:①反应原理:
乳酸常温下为易溶于水、乙醇等溶剂的液体;乳酸铝为白色或黄色粉末状固体,溶于水,不溶于乙醇等有机溶剂。
请回答:
(1)聚乳酸与NaOH加热回流合适的装置是_________,仪器a的名称_________。


(2)其他条件不变调整乳酸溶液质量分数,以及其他条件不变调整乳酸和铝的物质的最之比,得出如下实验数据。根据实验1-3,最合适的(乳酸)为_________。根据实验4-6,n(乳酸):n(铝)最合适的选择为3.025,不考虑实验原料价格,最可能的理由是:_________。
编号 | 时间/h | n(乳酸)∶n(铝) | (乳酸) | 产率(%) | 编号 | 时间/h | n(乳酸)∶n(铝) | (乳酸) | 产率(%) |
1 | 8 | 3.025 | 0.10 | 64.0 | 4 | 10 | 2.935 | 0.20 | 78.4 |
2 | 8 | 3.025 | 0.20 | 72.0 | 5 | 10 | 3.025 | 0.20 | 90.2 |
3 | 8 | 3.025 | 0.30 | 68.5 | 6 | 10 | 3.505 | 0.20 | 91.3 |
(3)抽滤I需对反应容器进行洗涤,并将洗涤液也抽滤。抽虑Ⅱ需对粗产品进行洗涤。所用洗涤剂最合适的分别是_________。
A.抽滤I洗涤剂用热水,抽虑Ⅱ洗涤剂用冷水;
B.抽滤I洗涤剂用滤液,抽虑Ⅱ洗涤剂用滤液;
C.抽滤I洗涤剂先用滤液再用无水乙醇,抽虑Ⅱ洗涤剂用无水乙醇;
D.抽滤I洗涤剂先用无水乙醇再用滤液,抽虑Ⅱ洗涤剂先用无水乙醇再用滤液。
(4)乳酸铝纯度测定方法如下:取ag乳酸铝(相对分子质量294)样品溶解,加入缓冲溶液调节pH值,加入bmLcmol·L-1的EDTA溶液。然后加入指示剂,用d mol·L-1的标准锌溶液滴定过量的EDTA溶液。Al3+和Zn2+与EDTA均1∶1反应。实验消耗标准锌溶液 emL,则乳酸铝纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
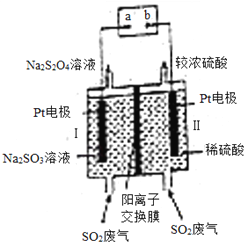
A. 电极Ⅱ为阳极,发生还原反应
B. 通电后H+通过阳离子交换膜向电极Ⅰ方向移动,电极Ⅱ区溶液pH增大
C. 阴极区电极反应式为:2SO2+2e﹣═S2O42﹣
D. 若通电一段时间后溶液中H+转移0.1mol,则处理标准状况下SO2废气2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种日常生活中不可缺少的调味品.已知C可在D中燃烧发出苍白色火焰,M与其他物质的转化关系如图所示(部分产物已略去)

(1)写出用惰性电极电解M溶液的离子方程式_____。
(2)比较B中各元素原子半径由大到小_____(填元素符号)。
(3)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是_____。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_____。
(5)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是_____。
(6)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为_____。

(7)若E可用于检验葡萄糖的存在,写出G溶液充分蒸发灼烧后的产物与乙醇反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断不正确的是
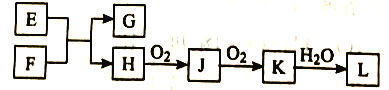
A. 若L为强碱,则E可能为NaCl溶液、F为钾
B. 若L为强酸,则E可能为NaHS、F为HNO3
C. 若L为弱酸,则E可能为Mg、F为CO2
D. 若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如图所示。

回答下列问题:
(1)氧化浸取时加入H2O2的目的是__________________________(只要回答出一点即可)。
(2)熔炼时加入Na2CO3的目的是除硅,该过程的化学方程式是_____________________________。
(3)加入NaOH溶液的目的是调节溶液的pH,水解时通入水蒸气的目的是_______________________。
(4)流程中加入N2H4·H2O还原得到银的化学方程式是_____________________________。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+)∶c(Ag+)=107时,溶液中的c(Cl-)=________mol·L-1。
(6)用流程中得到的铅制取Pb(NO3)2。用石墨作电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2,阳极发生的电极反应式是_______________________,若电解液中不加入Cu(NO3)2,阴极反应式是______________________,这样做的主要缺点是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L0.1 mol·L-1 NH4C1溶液中,逐渐加入NaOH固体粉末,随着n(NaOH)的变化,c(NH4+)与c(NH3·H2O)的变化趋势如下图所示(不考虑体积变化、氨的挥发、温度的变化)。下列说法正确的是( )

A. M点溶液中水的电离程度比原溶液大
B. 在M点时,n(OH-)+0.1 mol=(a+0.05)mol
C. 随着NaOH的加入,c(H+)/c(NH4+)不断减小
D. 当n(NaOH)=0.1 mol时,c(Na+)<c(NH4+)+c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com