
【题目】几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断不正确的是
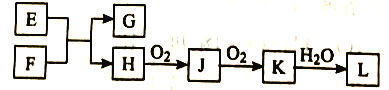
A. 若L为强碱,则E可能为NaCl溶液、F为钾
B. 若L为强酸,则E可能为NaHS、F为HNO3
C. 若L为弱酸,则E可能为Mg、F为CO2
D. 若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
【答案】A
【解析】
A、E为NaCl溶液、F为钾,G为KOH,H为H2,H2与O2生成H2O,H2O与O2不反应,故A错误;B、若L为强酸,则E可能为NaHS、F为HNO3,NaHS与HNO3生成Na2SO4和NO,NO与O2反应生成NO2,NO2与水反应生成HNO3,L是HNO3是强酸,故B正确;C、若L为弱酸,则E可能为Mg、F为CO2,Mg与CO2 反应生成MgO和C,C与O2反应生成CO,CO再与O2反应生成CO2,CO2溶于水生成H2CO3,L为H2CO3,是弱酸,故C正确; D.若L为强酸,则E可能为NH4Cl、F为Ca(OH)2,NH4Cl与Ca(OH)2反应生成CaCl2 和NH3,NH3与O2反应生成NO,NO与O2反应生成NO2,NO2溶于水生成HNO3,L是HNO3是强酸,故D正确;故选A。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应2SO2+ O22SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则
A.Q1=![]() QB.Q1<
QB.Q1<![]() QC.2Q1>QD.无法判断
QC.2Q1>QD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是
A. 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2
B. 等质量的NaHCO3和Na2CO3分別与足量盐酸反应,在同温同压下。生成的CO2体积相同
C. 物质的量浓度相同时,Na2CO3溶液的pH小于NaHCO3溶液
D. 向Na2CO3饱和溶液中通入CO2有NaHCO3结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是镁-空气燃料电池工作原理示意图,电池总反应为2Mg+O2+2H2O=2Mg(OH)2。下列有关该电池的说法正确的是( )
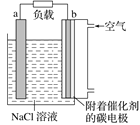
A.a极为负极,发生还原反应
B.b电极上电极反应:O2+2H2O+4e-=4OH-
C.工作时电子由b极经外电路流向a极
D.该装置实现了电能转化成化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少CO2的排放以及CO2的资源化利用具有重要意义。
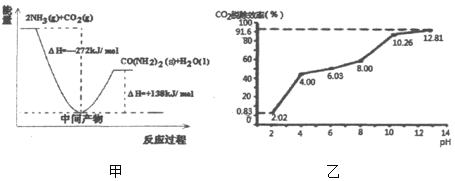
(1)H2NCOONH4是工业合成尿素[CO(NH2)2]的中间产物,该反应的能量变化示意图如图甲所示,用CO2和氨气合成尿素的热化学方程式为_____。
(2)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一。
①写出氨水捕集烟气中的CO2生成碳酸氢铵的主要化学方程式_____。
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图乙所示,烟气中CO2的含量为12%,烟气通入氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为_____(精确到0.01)。
③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是_____。
(3)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为2H2(g)+CO(g)CH3OH(g)△H=﹣90kJ/mol.在T1℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应过程如下图所示。
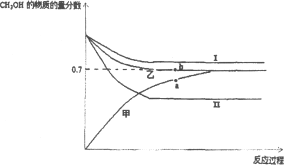
容器 | 甲 | 乙 | 丙 |
起始反应物投入量 | 2molH2、1molCO | 1molCH3OH | 2mol CH3OH |
①能代表丙反应的曲线是_____(选填I、II),a、b点的压强关系为Pa_____Pb(填>、<、=),理由是_____。
②b点时反应吸收的能量为_____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。试回答下列问题:

(1)氢气进入的这极为___极;
(2)写出氢氧燃料电池工作时的正极反应式:___;
(3)该氢氧燃料电池每转移0.1mol电子,消耗标准状态下___L氧气;
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究H2S的性质。实验室用硫化亚铁(难溶,块状)与盐酸反应制备硫化氢。他们设计装置如图所示。
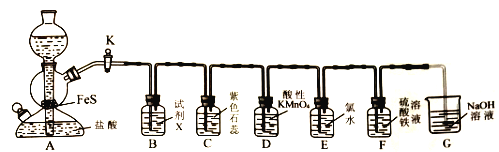
回答下列问题:
(1)停止A中反应的操作是________________。
(2)试制X可能是______(填代号)。
(a)氢氧化钠溶液 (b)硝酸 (c)饱和NaHS溶液 (d)氯化铁溶液
(3)写出A中发生反应的离子方程式:_________________。
(4)若E中产生浅黄色沉淀,则氧化性:Cl2____ S(填“>”“<”或“==”)。
(5)若观察到D中紫红色溶液变为无色溶液,则表明H2S具有的性质有_____(填代号)。
(a)酸性 (b)氧化性 (c)不稳定性 (d)还原性
(6)为了证明F中有Fe2+生成,取少量F中溶液于试管,微热溶液,冷却,向试管中滴加下列试剂中的____。(填代号)
①KSCN 溶液 ②酸化的双氧水 ③酸性高锰酸钾溶液 ④氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如右图所示。下列说法错误的是

A. Z与M的最高价氧化物对应水化物均为强酸
B. X、Y、Z三种元素组成的化合物可能是酸、碱或盐
C. 简单离子半径:M > Y > Q
D. 电解RM2水溶液可得到R单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com