
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在 100 mL 稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在 0~1、1~2、2~3、3~4、4~5 min 各时间段中:反应速率最大的时间段是_______________; 在 0~5min 内,反应速率变化的原因是______________________________________________________________________________________
(2)在 2~3 min 时间段内,用盐酸的浓度变化表示的反应速率为_______________
(3)为了减缓反应速率但不减少产生气的量,在盐酸中分别加入等体积的下列液体:
A.蒸馏水 B.Na2SO4 溶液 C.NaOH 溶液 D.H2SO4 溶液 E.Na2CO3
你认为可行的是(填编号)_______________。
(4)为了加快锌和盐酸的反应,采用了如图的装置。

此装置中负极为_______________,写出正极的电极反应式______________;
若收集到标况下 2.24L 气体,转移了电子_______________________mol,溶解了Zn______________g.
【答案】2~3min 开始反应时速率逐渐增大,因为反应放热,一段时间后速率减小,因为盐酸浓度减小 0.1mol·L-1·min-1 AB Zn 2H++2e-=H2↑ 0.2 6.5
【解析】
(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、58mL、20mL,生成气体体积越大的时间段,反应速率越大;结合温度、浓度对反应速率的影响分析;
(2)计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=![]() 计算反应速率;
计算反应速率;
(3)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量;
(4)形成原电池,Zn是活泼金属,电极表面发生氧化反应。
(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、58mL、20mL,由此可知反应速率最大的时间段为2~3min;在 0~5min 内,刚开始因为反应放热,温度升高,反应时速率逐渐增大,但一段时间后因为盐酸浓度减小,反应速率逐渐减小。
(2)在2~3min时间段内,n(H2)=![]() =0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则υ(HCl)=
=0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则υ(HCl)= =0.1mol/(Lmin);
=0.1mol/(Lmin);
(3)A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;
B.加入Na2SO4溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;
C.加入NaOH 溶液,中和盐酸,H+浓度减小,反应速率减小且影响生成氢气的量,故C错误;
D.加入H2SO4 溶液,H+浓度改变,反应速率改变且影响产生氢气的量,故D错误;
E.加入Na2CO3溶液,消耗H+,H+浓度减小,反应速率减小且影响生成氢气的量,故E错误;
故答案为AB。
(4)形成原电池,装置中Zn比Cu活泼,Zn为负极,正极上H+得电子发生还原反应,电极反应式为2H++2e-=H2↑;标况下2.24L氢气的物质的量为0.1mol,则转移电子0.2mol,溶解了Zn的质量为65g/mol×![]() =6.5g。
=6.5g。


科目:高中化学 来源: 题型:
【题目】曲酸和脱氧曲酸是一种非常有潜力的食品添加剂,结构分别如下图所示。下列有关叙述不正确的是
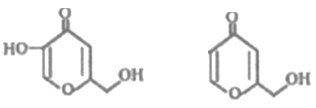
A.曲酸分子中所有碳原子不可能共平面
B.脱氧曲酸能发生酯化反应、氧化反应、还原反应
C.曲酸和脱氧曲酸所含的官能团相同
D.与脱氧曲酸互为同分异构体的芳香族化合物有4种(不考虑O-O键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和 W在元素周期表中的位置如下图所示, 其最外层电子数之和为21。下列说法中正确的是
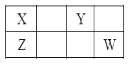
A. 单质W可由海水作原料获得
B. Y 的非金属性比 X的强,所以Y的氢化物一定比 X的更稳定
C. 工业上常利用单质 X与含 Z氧化物的矿石在高温下反应制备高纯 Z
D. X的氢化物可以与 W的单质发生反应,但是不能与 W 的氢化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是___。
a.反应速率v(NH3)=v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
e.12mol N-H键断裂的同时生成5mol N≡N键
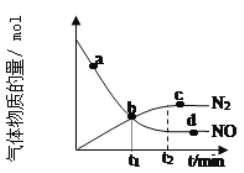
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正)___v(逆);d点对应的速率关系是v(正)___v(逆)。(填﹥、﹤或﹦)。
(2)一定条件下,在2L密闭容器内,反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
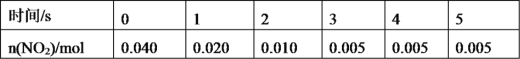
①用N2O4表示0~2s内该反应的平均速率为___。在第5s时,NO2的转化率为___。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末 X 中可能含有 Fe2O3、CuO、MnO2、CaO、NaCl 和 K2CO3 中的若干种。为确定该固体粉末的成分,进行了以下实验(所加试剂均过量):
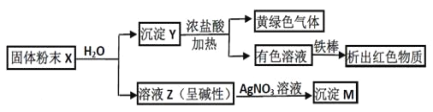
下列结论正确的是:
A. 固体粉末中一定含 K2CO3B. X 中可能存在 Fe2O3
C. 沉淀 M 一定含 AgClD. 沉淀 Y 中不一定存在 MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究硝酸的性质设计并完成如下实验:
a、某兴趣小组设计如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞 b,试管 d 中加水至浸没长导管口,塞紧试管 c 和 d 的胶塞,加热 c,其目的是__________
(2)在 d 中加适量 NaOH 溶液,c 中放一小块铜片,由分液漏斗 a 向 c 中加入2mL 浓硝酸,c 中反应的离子方程式___________________________________________;再由 a 向 c 中加 2mL 蒸馏水、写出 c 中可能进行的两个反应的化学方程式_______________________________________;________________________________________.
b、室温下,将铁片分别置于适量的稀 HNO3 和浓 HNO3 中(如图所示)。

(1)气球的作用是_____________________________________
(2)A中溶液最终变为浅绿色,发生反应的离子方程式是______________________
(3)B 中无明显变化,该同学进一步探究如下:假设①常温下铁与浓硝酸不反应。②_______________________
进行实验:将 B 中的铁片取出并洗净后,放入 CuSO4 溶液中,无明显变化, 则说明假设①_____________(填“成立”或“不成立”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜片放入 115mL 某浓度的浓硫酸中,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应,收集到 2.24L(标准状况下)氢气。过滤残留固体,干燥后称量,质量减轻了 7.5g。求原硫酸的物质的量浓度________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答相关的问题。
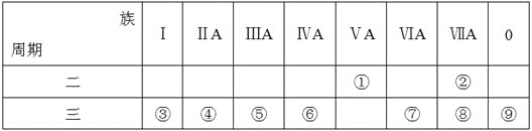
(1)写出④的元素符号__。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:__。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是__(填相应化学式,下同),碱性最强的是__。
(4)这些元素中(除⑨外),原子半径最小的是__(填元素符号,下同),原子半径最大的是__。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2,(O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)__。
(6)⑦的低价氧化物通入足量Ba(NO3)2溶液中的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写错误的是( )
A.![]() +HO-NO2
+HO-NO2![]()
![]() +H2O
+H2O
B.nCH2=CH2![]()
C.CH3COOH+CH3CH2OH![]() H2O+CH3COOCH2CH3
H2O+CH3COOCH2CH3
D.2CH3CH2OH+O2![]() 2CH3CHO
2CH3CHO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com