
 .
.分析 A、B、D、E、Y为5种短周期元素,A的原子的最外层电子数是其次外层电子数的2倍,则A原子有2个电子层,最外层电子数为4,则A为碳元素;A、B、D位于同一周期,处于第二周期,D的氢化物是最常用的溶剂,则D为氧元素;B的原子序数大于A小于D,则B为N元素;D、Y位于同一主族,则Y为硫元素;E的单质是一种生活中常见的金属,则E为Al元素,据此进行解答.
解答 解:A、B、D、E、Y为5种短周期元素,A的原子的最外层电子数是其次外层电子数的2倍,则A原子有2个电子层,最外层电子数为4,则A为碳元素;A、B、D位于同一周期,处于第二周期,D的氢化物是最常用的溶剂,则D为氧元素;B的原子序数大于A小于D,则B为N元素;D、Y位于同一主族,则Y为硫元素;E的单质是一种生活中常见的金属,则E为Al元素,
(1)CO2中具有的化学键属于极性共价键,故答案为:极性共价键;
(2)高温时,6gC的单质与水蒸气反应生成两种还原性气体,则生成CO与氢气,吸收的热量为65.75kJ,则1mol碳发生该反应放出的热量为65.75kJ×$\frac{1mol×12g/mol}{6g}$=131.5kJ,故该反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5 kJ/mol,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5 kJ/mol;
(3)O元素与氢元素可组成含有10个电子的OH-,与OH-组成元素相同,原子数个数比也相同的分子为H2O2,其电子式是 ,
,
故答案为: ;
;
(4)SO2气体通入足量BaCl2和HNO3的混合溶液中,硝酸氧化亚硫酸为硫酸,硝酸被还原为NO,生成的硫酸与氯化钡反应生成硫酸钡白色沉淀,反应的离子方程式是:3Ba2++3SO2+2NO3-+2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:3Ba2++3SO2+2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
点评 本题考查结构性质位置关系,题目综合性较大,涉及化学键、热化学方程式书写、化学平衡移动、盐类水解应用、氧化还原反应与元素化合物性质等,难度中等,推断元素是解题关键,注意对基础知识的理解掌握.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸 | B. | 金刚石和石墨 | ||
| C. | ${\;}_{8}^{16}$O和${\;}_{8}^{17}$O | D. | CH3CH2CH2CH3和 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
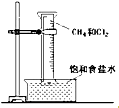 按要求书写:
按要求书写: ;-CH3
;-CH3

 系统命名法的名称3,3-二甲基-5-乙基庚烷
系统命名法的名称3,3-二甲基-5-乙基庚烷查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,氧化剂是氯酸钾,还原产物是Cl2.
,氧化剂是氯酸钾,还原产物是Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 儿童牙膏 | 防臭牙膏 | 透明牙膏 | |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 氧化硅 |
| 物质类别 | 碱 | 盐 | 氧化物 |
 ,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.
,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数是指在一定温度下生成物浓度幂之积与反应物浓度幂之积的比值 | |
| B. | 勒夏特列原理指的是,如果改变影响平衡的条件之一(如温度、压强、参与反应物质的浓度,),平衡将向着能够减弱这种改变的方向移动 | |
| C. | 盐溶液不一定呈中性,不显中性的盐都会促进水的电离 | |
| D. | 把被保护的钢铁设备作为电解池的阴极,该方法称为牺牲阳极的阴极保护法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com