
����Ŀ������ɫɫ�����ʣ������������������ͷ����硣�����������Ī�⣬�����������ǰ���������������ѧϰ���ʽṹ�����ʵ�֪ʶ����ʹ������ij���ø���������
��1����̬Gaԭ�ӵĺ�������Ų�ʽ��__����̬Gaԭ�Ӻ������ռ������ܼ��ĵ���������ͼΪ___��
��2��HC��CNa(��Ȳ��)�㷺�����л��ϳɣ���Ȳ����Cԭ�ӵ��ӻ�����Ϊ__����Ȳ���д���__(����ĸ���)��
A.������ B.���� C.���� D.��� E.��λ�� F.���Ӽ� G.���»���
��3��NaN3��������ȫ�����е���Ҫ��ѧ�ɷ֣���������Ϊ���幹��Ϊ__��д���������ӻ�Ϊ�ȵ������һ�ַ��ӵĽṹʽ__(дһ��)��
��4���ƺ������ǵ�������Ԫ�أ���ԭ�ӵ�������������ͬ���������۷е�Զ���ڸƣ���ԭ����__��
��5��ij���Ӿ���ľ����ṹ��ͼ��ʾ��
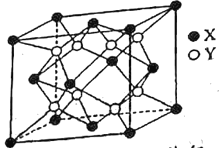
�پ�������ÿ��X��Χ��������Ҿ�����ȵ�X����__����
����þ����Ħ������ΪMg��mol-3���������ܶ�Ϊ��g��cm-3�������ӵ�����ΪNA�����������������X��ľ���Ϊ__cm��
���𰸡���Ar��3d104s24p1 ������ sp�ӻ� BCF ֱ���� O=C=O Fe�ļ۵������϶���ԭ�Ӱ뾶��С����������ǿ 12 ![]()
��������
��1��Gaԭ�Ӻ�����31�����ӣ������������ԭ������̬Gaԭ�Ӻ�������Ų�ʽ�ǣ�Ar��3d104s24p1����̬Gaԭ�Ӻ������ռ�ݵ�����ܼ���4p�ܼ�������������ͼΪ�����Σ�
��2��HC��CNa��Cԭ�ӵŵ��Ӷ���Ϊ0���۵��Ӷ���Ϊ2������Cԭ�ӵ��ӻ�����Ϊsp�ӻ�����Ȳ����C-H��Ϊ������C��C��1��������2��������Na��C��CH֮��Ϊ���Ӽ�����ѡBCF��
��3��NaN3��������ΪN3-������Nԭ�ӵļ۵��Ӷ�����![]() ����λԭ����Ϊ2���µ��Ӷԣ�����N3-���幹��Ϊֱ���Σ�ԭ������ͬ���۵�����Ҳ��ͬ�����ӻ�Ϊ�ȵ����壬N3-�۵�������16����N3-��Ϊ�ȵ�����ķ�����CO2���ṹʽΪO=C=O��
����λԭ����Ϊ2���µ��Ӷԣ�����N3-���幹��Ϊֱ���Σ�ԭ������ͬ���۵�����Ҳ��ͬ�����ӻ�Ϊ�ȵ����壬N3-�۵�������16����N3-��Ϊ�ȵ�����ķ�����CO2���ṹʽΪO=C=O��
��4��Fe�ļ۵������϶���ԭ�Ӱ뾶��С����������ǿ�����������۷е�Զ���ڸƣ�
��5���ٸ��ݾ����ṹͼ��Xԭ�ӹ���������������������ÿ��X��Χ��������Ҿ�����ȵ�X����12����
�ڸ��ݾ�̯ԭ��ÿ����������4��Xԭ�ӡ�8��Yԭ�ӣ���þ����Ħ������ΪMg��mol-3���ܶ�Ϊ��g��cm-3�������ӵ�����ΪNA�������߳�Ϊacm����![]() ��
�� �����������������X��ľ���Ϊ������Խ��ߵ�һ�룬����Ϊ
�����������������X��ľ���Ϊ������Խ��ߵ�һ�룬����Ϊ![]() cm��
cm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I��һ��ҩ��ϳ��м��壬��I��صķ�Ӧ���£�
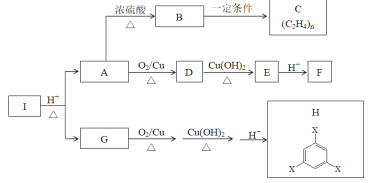
����������Ϣ�ش��������⡣
(1)B��C�ķ�Ӧ������___________��
(2)д��D��E�Ļ�ѧ����ʽ___________��
(3)����˵����ȷ����____________
A.����H�еĹ�����XΪ��COOH B.����C�Ǵ�����
C.�л���A��B���������ʵ���֮�Ȼ�ϣ�ֻҪ�����������ʵ�����ͬ����ô�������ȼ�����ĵ�����������ͬ
D.��ҵ��������B��O2�ڴ��������¿�������������
(4)ʵ����ȡ1.96g G��ȫȼ�գ���ȼ�ղ���ͨ����ʯ�ң���ʯ����������4.68g������ȼ�ղ���ͨ��Ũ���ᣬŨ�������������0.72g��G�ķ���ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ӣ���к���һ���ǻ���(��M��ʾ)��M��̼���ṹ��֧��������ʽΪC4H6O5��1.34 g M��������̼��������Һ��Ӧ�����ɱ�״���µ�����0.448 L��M��һ�������¿ɷ�������ת����M![]() A
A![]() B
B![]() C(M��A��B��C������̼ԭ����Ŀ��ͬ)�������й�˵���в���ȷ����(����)
C(M��A��B��C������̼ԭ����Ŀ��ͬ)�������й�˵���в���ȷ����(����)
A. M�Ľṹ��ʽΪHOOC��CHOH��CH2��COOH
B. B�ķ���ʽΪC4H4O4Br2
C. ��M�Ĺ��������ࡢ������ȫ��ͬ��ͬ���칹�廹��2��
D. C���ʲ���������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijDZˮ���ṩ�����ĵ����ͼ��ʾ�������й�˵����ȷ���ǣ� ��
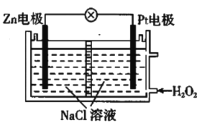
A.Zn�������˻�ԭ��Ӧ
B.����е�Na+��Zn�缫�ƶ�
C.Pt�缫��ӦʽΪH2O2+2e-=2OH-
D.���Ӵ�Zn�缫�ص�������Pt�缫���پ���Һ�ص�Zn�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ̼��ѧ����ָ�Ժ�һ��̼ԭ�ӵĻ�����(��CO2��CO��CH4��CH3OH��)Ϊ��ʼ��Ӧ��ϳ�һϵ����Ҫ�Ļ���ԭ�Ϻ�ȼ�ϵĻ�ѧ��
��1����CO2��NH3Ϊԭ�Ϻϳ�����������CO2�ijɹ������������غϳ����е���Ҫ��Ӧ�ɱ�ʾ���£�
��ӦI��2NH3(g)+CO2(g)![]() NH2COONH4(s) H1
NH2COONH4(s) H1
��ӦII��NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
�ܷ�Ӧ��2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
��ش��������⣺
�ٷ�ӦI��H1=__kJ/mol��
�ڷ�ӦIIһ����__(�������»�������")�����������ڸ÷�Ӧ�Ľ��С�
��һ���¶��£�������̶����ܱ������а�������Ͷ�Ͻ��з�ӦI��������˵����Ӧ�ﵽ��ƽ��״̬����__(����ĸ���)��
A.��������ƽ����Է����������ٱ仯
B.������������ѹǿ���ٱ仯
C.2v��(NH3)=v��(CO2)
D.�����ڻ��������ܶȲ��ٱ仯
��2����CO2��H2�����ʵ���֮��Ϊ1��3����һ��������ܱ������У�������Ӧ��CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H�����CH3OH�����ʵ����ڲ�ͬ�¶�����ʱ��ı仯��ϵ��ͼ��ʾ��
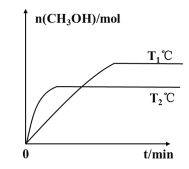
�ٸ���ͼʾ�ж�H__0(����>������<��)��
��һ���¶��£����ݻ���Ϊ2L�������ܱ������У������·�ʽ���뷴Ӧ�10min��ﵽƽ�⡣
���� | �� | �� |
��Ӧ��Ͷ���� | 1molCO2��3molH2 | amolCO2��bmolH2 cmolCH3OH(g)��cmolH2O(g)(a��b��c����Ϊ��) |
��������ƽ��������ѹǿΪ��ʼʱ��0.8������Ӧ10min�ڼ���������CH3OH(g)��ʾ�Ļ�ѧ��Ӧ����Ϊ__�����¶��µĻ�ѧƽ�ⳣ��Ϊ__(������λС��)��Ҫʹƽ��������������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У�����������c��ȡֵ��ΧΪ__��
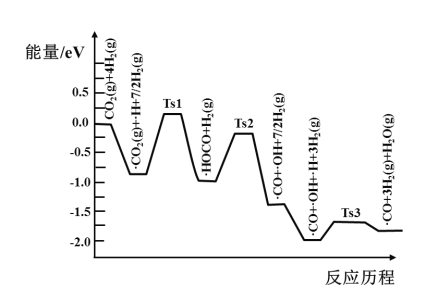
��3�������ɽ�CO2��ԭΪ���飬��ӦΪCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)��ShyamKattel�Ƚ��ʵ��������ģ�������о�����Pt/SiO2����������CO2��H2�ķ�Ӧ���̣�ǰ����������ͼ��ʾ����������Pt/SiO2������������������ע��Ts��ʾ����̬�����������ڴ������棬�γɹ���̬�Ĺ��̻�__(�����ų���������������������)����Ӧ��������С����(���)����Ļ�ѧ����ʽΪ__��
CH4(g)+2H2O(g)��ShyamKattel�Ƚ��ʵ��������ģ�������о�����Pt/SiO2����������CO2��H2�ķ�Ӧ���̣�ǰ����������ͼ��ʾ����������Pt/SiO2������������������ע��Ts��ʾ����̬�����������ڴ������棬�γɹ���̬�Ĺ��̻�__(�����ų���������������������)����Ӧ��������С����(���)����Ļ�ѧ����ʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����������ʵ��̽�������е�Ԫ�صĴ�����ʽ��̽��������ͼ��

��1������IΪ���գ�������ʱӦ����___(��������)ʢװ����������IIΪ___��
��2��ˮ��ʱͨ��Ҫ������Һ���2-3min��Ŀ����___��
��3������III����ͬѧ�Ƕ���ҺA�е�Ԫ�صĴ�����ʽ���е�̽��ʵ�顣
�Ʋ⣺����IO![]() ��ʽ���ڢ���I-��ʽ����
��ʽ���ڢ���I-��ʽ����
�������ϣ�IO![]() ���н�ǿ�������Խ�������Һϡ�����Ƴ�200mL��Һ�����������ʵ��̽����
���н�ǿ�������Խ�������Һϡ�����Ƴ�200mL��Һ�����������ʵ��̽����
��ѡ�Լ���3%H2O2��Һ��KSCN��Һ��FeC12��Һ��ϡ����
��� | ʵ����� | ʵ������ | ���� |
�� | ȡ����ϡ�ͺ����ҺA������ۺ��� �������ữ����װ���Թ�I��II | ������ | |
�� | ���Թ�I�м���FeC12��Һ��Ȼ�����2��KSCN��Һ���� | ___ | ֤��������IO |
�� | ���Թ�II�м���___�� | ____ | ֤����I-��ʽ���� |
��4��ȡ20mLϡ�ͺ���ҺA����ƿ���μ�0.01mo1/LKMnO4��Һ����Һ����dz��ɫ����I-����ΪI2���õ���ҺB����֪�����������£�MnO![]() �Ļ�ԭ����ΪMn2+��д�����ӷ���ʽ___��
�Ļ�ԭ����ΪMn2+��д�����ӷ���ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�ͭ���壨CuCl2��2H2O���к���FeCl2���ʣ�Ϊ�Ƶô������Ȼ�ͭ���壬���Ƚ����Ƴ�ˮ��Һ���ٰ���ͼ��ʾ�IJ�����������ᴿ��
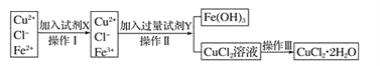
������±�������������ա�

��1������I����X��Ŀ����___________________________ ��
��2���������ʶ�������ΪX���ʺϱ�ʵ���X���ʿ�����_________������ĸ����
A KMnO4 B NaClO C H2O2 D Cl2
��3������II��Y�Լ�Ϊ____________���ѧʽ������������Һ��pH��______��Χ��
��4��ʵ����������CuCl2��Һʱ���������_________�����������ƣ��������ǣ��������������й����ӷ���ʽ��ʾ��__________________________________________��
��5������CuCl2��Һ�������գ��õ��Ĺ�����_________________���ѧʽ������Ҫ����ˮCuCl2���������������______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������������Ժ� CO2 ������Ӧ��Fe(s)��CO2(g)FeO(s)��CO(g)��һ���¶��£���ij�ܱ������м����������۲�����һ������ CO2 ���壬��Ӧ������ CO2 ����� CO �����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��

(1)t1 ʱ�������淴Ӧ���ʵĴ�С��ϵΪ v ��_____v ��(����������������������)��
(2)4 min �ڣ�CO ��ƽ����Ӧ���� v(CO)��_____��
(3)���������ĸı��ܼ����䷴Ӧ���ʵ���_____(����ţ���ͬ)��
�ٽ����¶�
�ڼ������۵�����
�۱���ѹǿ���䣬���� He ʹ�������������
�ܱ����ݻ����䣬���� He ʹ��ϵѹǿ����
(4)����������˵��������Ӧ�Ѵ�ƽ��״̬����_____��
��v(CO2)��v(CO)
�ڵ�λʱ�������� n mol CO2 ��ͬʱ���� n mol CO
������������ѹǿ����ʱ��仯���仯
�������������ƽ����Է�����������ʱ��仯���仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100mol��L1��NaOH��Һ�ֱ�ζ���Ϊ20.00mL0.100mol��L1��HCl��Һ�ʹ�����Һ���ζ�������ͼ��ʾ������˵����ȷ����
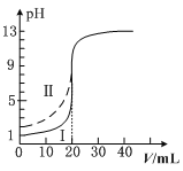
A.���ʾ���ǵζ����������
B.pH=7ʱ���ζ��������ĵ�V��NaOH����20.00mL
C.V��NaOH����20.00mLʱ��������Һ��c��Cl������c��CH3COO����
D.V��NaOH����10.00mLʱ��������c��Na+����c��CH3COO������c��H+����c��OH����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com