
【题目】化合物I是一种药物合成中间体,与I相关的反应如下:
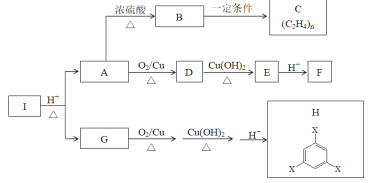
根据以上信息回答下列问题。
(1)B→C的反应类型是___________。
(2)写出D→E的化学方程式___________。
(3)下列说法正确的是____________
A.物质H中的官能团X为—COOH B.物质C是纯净物
C.有机物A和B以任意物质的量之比混合,只要混合物的总物质的量相同,那么混合物充分燃烧消耗的氧气的量相同
D.工业上用物质B与O2在催化剂条件下可生产环氧乙烷
(4)实验室取1.96g G完全燃烧,将燃烧产物通过碱石灰,碱石灰质量增加4.68g;若将燃烧产物通过浓硫酸,浓硫酸的质量增加0.72g。G的分子式是___________。
【答案】加聚反应 CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O ACD C9H8O5
CH3COONa+Cu2O↓+3H2O ACD C9H8O5
【解析】
C为聚乙烯,那么B为乙烯,B生成C的反应即加聚反应;由A依次生成D,E,F的条件可知,A中一定有羟基,所以A为乙醇;由G生成H的条件可知,G中一定含有羟基,H中一定含有羧基,所以H中的-X即为羧基;根据(4)中提供的燃烧的相关信息,可计算出G的分子式,结合前面推出的信息就可以确定G的结构中含有两个羧基,1个羟基。
(1)通过分析可知,B生成C即乙烯生成聚乙烯的反应,反应类型为加聚反应;
(2)D生成E的反应即乙醛与弱氧化剂Cu(OH)2反应的反应;方程式为:CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O;
CH3COONa+Cu2O↓+3H2O;
(3)A.通过分析可知,H中X的官能团为羧基,A项正确;
B. 物质C为聚乙烯,高分子有机化合物都是混合物,B项错误;
C.A为乙醇,1mol乙醇完全燃烧消耗3molO2;B为乙烯,1mol乙烯完全燃烧消耗也是3molO2,所以A与B无论何种比例混合,只要混合物的总物质的量相同,则完全燃烧消耗的氧气的量就相同,C项正确;
D.乙烯可以在银的催化下与O2反应生成环氧乙烷,工业上可以采用这种方法生产环氧乙烷,D项正确;
答案选ACD;
(4) 1.96gG中含有H0.08g即0.08mol,含有C1.08g即0.09mol,那么O的质量为0.8g即0.05mol,再结合推断流程分析可知,G分子式为C9H8O5。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.甲烷分子的比例模型为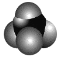 ,其二氯取代物有 2 种结构
,其二氯取代物有 2 种结构
B.苯和乙烯都能使溴水褪色,其褪色原理相同
C.相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D.在一定条件下,乙烯与氢气反应生成乙烷属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铜片、锌片和200 mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:
(1)反应中消耗的锌的质量是多少______?
(2)有多少个电子通过了导线______?
(3)原稀H2SO4的物质的量浓度是多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题:
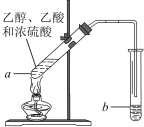
(1)乙醇分子中官能团的名称是___________。
(2)试管a中加入几块碎瓷片的目的是________。
(3)试管a中发生反应的化学方程式为________
(4)反应开始前,试管b中盛放的是_________溶液。
(5)可用____________的方法把制得的乙酸乙酯分离出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa’处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是
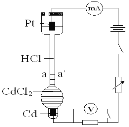
A.通电时,H+、Cd2+向Pt电极迁移,Cl-向Cd电极迁移
B.装置中总反应的化学方程式为:Cd + 2HCl![]() CdCl2 + H2↑
CdCl2 + H2↑
C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍
D.如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用右图所示装置制备CO2气体,其中K为止水夹,多孔塑料板固定在试管的某一位置。请问答以下问题:
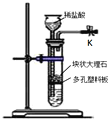
(1)当止水夹K打开时,大理石即可与稀盐酸反应产生CO2气体;当止水夹关闭后,该反应可随后停止。起到这种随关随停作用的主要原因是 __________
(2)实验室可以利用上述装置制备某些气体,能达到随开随用,随关随停的有__________
A.锌粒和稀硫酸制氢气 B.浓盐酸和二氧化锰制取氯气
C.Na2SO3固体和硫酸反应制备SO2 D.利用FeS块状固体与稀硫酸反应制备H2S气体
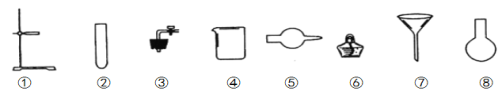
(3)请你选用如图所示的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。应选用的仪器是__________(填仪器的编号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol/I.的NH4HCO3溶液中逐渐加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。根据图象,下列说法不正确的是( )

A. 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O
B. 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C. pH=9.5时,溶液中c(HCO3-)>c(NH3H2O)>c(NH4+)>c(CO32-)
D. 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有K+、![]() 、Ca2+、Cl-、
、Ca2+、Cl-、![]() 、
、![]() 中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法不正确的是( )
中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法不正确的是( )
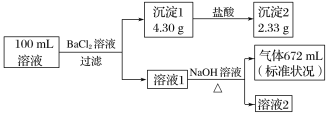
A.原溶液中一定存在![]() 、
、![]() 和
和![]()
B.原溶液中一定不存在Ca2+,无法判断Cl-是否存在
C.要确定Cl-是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D.原溶液中c(K+)≥0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理”的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是__,基态Ga原子核外电子占据最高能级的电子云轮廓图为___。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为__;乙炔钠中存在__(填字母序号)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子为立体构型为__;写出和该阴离子互为等电子体的一种分子的结构式__(写一个)。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,但铁的熔沸点远高于钙,其原因是__。
(5)某离子晶体的晶胞结构如图所示。
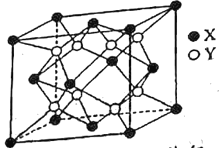
①晶体中在每个X周围与它最近且距离相等的X共有__个。
②设该晶体的摩尔质量为Mg·mol-3,晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为__cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com