
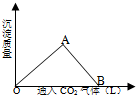
 (1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.
(1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.分析 (1)AB段曲线是碳酸钙与二氧化碳、水反应转化为碳酸氢钙,B处最终为Ca(HCO3)2溶液,煮沸蒸干中Ca(HCO3)2分解为碳酸钙、二氧化碳与水;
(2)①反应中S既是氧化剂又是还原剂,氧化剂得到还原产物K2S,还原剂得到氧化产物K2SO3;
②根据参加反应的S计算生成K2SO3的物质的量,再结合S元素化合价变化计算转移电子.
解答 解:(1)AB段曲线是碳酸钙与二氧化碳、水反应转化为碳酸氢钙,反应方程式为:CaCO3+CO2+H2O═Ca(HCO3)2,
B处最终为Ca(HCO3)2溶液,煮沸蒸干中Ca(HCO3)2分解为碳酸钙、二氧化碳与水,反应方程式为:Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O,
故答案为:CaCO3+CO2+H2O═Ca(HCO3)2;Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O;
(2)①反应中S既是氧化剂又是还原剂,氧化剂得到还原产物K2S,还原剂得到氧化产物K2SO3,由还原产物、氧化产物的化学计量数,可知反应中氧化剂与还原剂的物质的量之比为2:1,
故答案为:2:1;
②由方程式可知生成K2SO3的物质的量为3mol×$\frac{1}{3}$=1mol,转移电子为1mol×(4-0)=4mol,
故答案为:4.
点评 本题考查氧化还原反应概念与计算、元素化合物性质,难度不大,根据化合价判断氧化剂与还原剂、还原产物与氧化产物是关键,判断后也可根据电子转移守恒计算氧化剂与还原剂的物质的量之比.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| B. | 粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| C. | 用Pt电极电解氯化铝溶液:2Cl-+2 H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2+2OH- | |
| D. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸 | B. | 乙醛 | C. | 甲酸乙酯 | D. | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com