
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C分析 (1)若A是一种黄色单质固体,则A为S,与氧气反应生成B为SO2,进一步与氧气反应生成C为SO3;
(2)若A是一种活泼金属,C是淡黄色固体,则A为Na、B为Na2O、C为Na2O2,C长期露置于空气中,经过系列变化,最后将变成物质D,D为Na2CO3;
混合物加热,发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,利用差量法计算混合物中碳酸氢钠的质量,进而计算碳酸钠的质量分数;
(3)若C是红棕色气体,A可能是一种能用如图装置制取的气体即用氯化铵与氢氧化钙加热制得的气体,则A为NH3,B为NO,C为NO2.
解答 解:(1)若A是一种黄色单质固体,则A是S单质,属于B是二氧化硫,C是三氧化硫,则B→C的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3,
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;
(2)若A是一种活泼金属,C是淡黄色固体,则A为Na、B为Na2O、C为Na2O2,C长期露置于空气中,经过系列变化,最后将变成物质D,D为Na2CO3,过氧化钠能与CO2反应生成碳酸钠与氧气,反应的化学方程式是2Na2O2+2 CO2=2 Na2CO3+O2↑,
令混合物中碳酸氢钠的质量为m,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 质量减少
168 62
m 10g-9.38g=0.62g
故m=$\frac{168×0.62g}{62}$=1.68g,故碳酸钠的质量分数=$\frac{10g-1.68g}{10g}$×100%=83.2%,
故答案为:过氧化钠;83.2%;
(3)若C是红棕色气体,A可能是一种能用如图装置制取的气体即用氯化铵与氢氧化钙加热制得的气体,则A为NH3,B为NO,C为NO2,
①实验室用氢氧化钙和氯化铵在加热条件下反应准备氨气,反应的方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②A为氨气,极易溶于水,密度比空气小,可用向下排空气法收集,检验氨气是否收集满,可将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满,或用白色的酚酞试纸置于试管口处,若试纸变红,则证明氨气已收集满,也可以用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满,
故答案为:向下排空气法;将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满;
(或用白色的酚酞试纸置于试管口处,若试纸变红,则证明氨气已收集满)
(或用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满)
③n(NH4Cl)=$\frac{5.35g}{53.5g/mol}$=0.1mol,则n(NH3)=0.1mol,V(NH3)=2.24L,
故答案为:2.24.
点评 该题考查无机框图题的判断,是高考中的常见题型,属于基础性试题的考查,试题难易适中,侧重对学生基础知识的巩固训练,物质特殊的颜色是推断的突破口.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用镊子夹取钠块,吸干表面的煤油后,用小刀切下一部分进行实验.剩余的钠应放回原试剂瓶 | |
| B. | 钠加热后先熔化成小球状,这是因为金属钠的熔点较低 | |
| C. | 钠燃烧时火焰呈黄色,这与钠元素的焰色反应有关 | |
| D. | 钠块表面若有部分已被氧化为Na2O,充分燃烧后将得到Na2O和Na2O2的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业合成氨 | |
| B. | 雷雨闪电时,大气中产生了一氧化氮 | |
| C. | 豆科作物的根瘤菌将空气中的氮转化为氨 | |
| D. | 在一定条件下由氨气和二氧化碳合成尿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
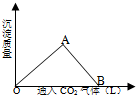 (1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.
(1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和同体积同浓度的HAc和HCl,所需碱的物质的量是相同的 | |
| B. | 由H2CO3的解离平衡,可知溶液中[H+]和[CO32-]的比值=2:1 | |
| C. | 某弱酸溶液越稀,其电离度越大 | |
| D. | 强电解质溶液无离解常数,但可以有溶度积常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+H+ Ba2+ |
| 阴离子 | OH- CO${\;}_{3}^{2-}$ SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
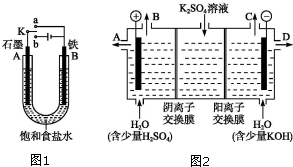 某课外活动小组用如图装置进行实验,试回答下列问题:
某课外活动小组用如图装置进行实验,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com