
物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):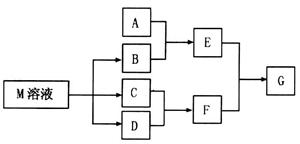
(1)写出用惰性电极电解M溶液的离子方程式 。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是 。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是 。
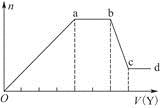
(5)若A是一种溶液,只可能含有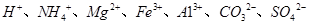 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。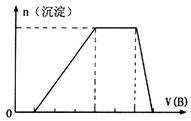
(1)2Cl?+2H2O 2OH?+H2↑+Cl2↑(2分)
2OH?+H2↑+Cl2↑(2分)
(2)H2SiO3(1分)
(3)溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失(1分)
(4)4Fe2++8OH?+O2 +2H2O = 4Fe(OH)3↓(2分)
(5)c(H+):c(Al3+):c(NH4+):c(SO42?)=1:1:2:3(2分,推断出前三种且结果正确得1分)
解析试题分析:C可在D中燃烧发出苍白色火焰,可知二者分别为H2、Cl2,F为HCl,物质M是一种日常生活中不可缺少的调味品,为NaCl,则B为NaOH 。
(1)用惰性电极电解NaCl溶液,生成NaOH、H2、Cl2,离子方程式为:
2Cl?+2H2O 2OH?+H2↑+Cl2↑
2OH?+H2↑+Cl2↑
(2)若A是一种酸性氧化物,且可用于制造玻璃,则A为SiO2,与NaOH反应生成的E为Na2SiO3,与HCl反应生成的G为H2SiO3。
(3)A是一种常见金属单质,能与NaOH溶液反应,则A为Al,E为Na[Al(OH)4],将过量的盐酸逐滴加入Na[Al(OH)4]溶液,边加边振荡,Na[Al(OH)4]先与HCl反应生成Al(OH)3,继续加入HCl,Al(OH)3与HCl反应生成AlCl3,所以实验现象为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。
(4)A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A中含Fe2+,生成的E为Fe(OH)3,发生的反应有:Fe2++2OH?=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,两步反应加和可得离子方程式:4Fe2++8OH?+O2 +2H2O = 4Fe(OH)3↓
(5)根据图像,设图像中加入单位体积的NaOH溶液含NaOH为1mol,加入第一部分NaOH没有沉淀生成,发生的反应为:OH?+H+=H2O,则原溶液含H+,物质的量为1mol;继续加入3mol NaOH生成沉淀,最后加入1mol NaOH,Al(OH)3溶解,则原溶液含Al3+,物质的量为1mol;则Mg2+、Fe3+、CO32?一定不存在;中间加入2mol NaOH,沉淀不变,发生的反应为OH?与NH4+反应,则原溶液含NH4+,物质的量为2mol,阴离子只能为SO42?,根据电荷守恒可得SO42?的物质的量为3mol,所以c(H+):c(Al3+):c(NH4+):c(SO42?)=1:1:2:3
考点:本题考查物质的推断、离子方程式的书写、实验现象、离子的推断与计算。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
(10分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7 + H2SO4(稀) CO2↑+ Cr2 (SO4) 3+ + .
CO2↑+ Cr2 (SO4) 3+ + .
(1)此反应的氧化剂是 ,被氧化的元素是 。
(2)完成并配平上述反应的化学方程式。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | 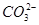 、 、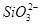 、 、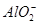 、Cl- 、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、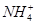 、Na+ 、Na+ |
 Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无
色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如下表。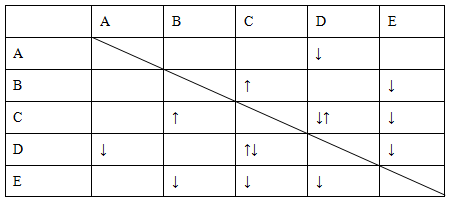
表中“↑”表示生成气体物质,“↓”表示生成沉淀。
根据以上信息,回答以下问题。
(1)B、E的化学式分别为________、________。
(2)写出A的电离方程式:________。
(3)C、D两溶液反应的离子方程式为________。
(4)向含有0.1 mol溶液的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为 。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。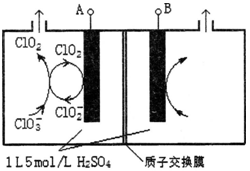
①电源负极为 极(填A或B):
②写出阴极室发生反应依次为: 、
;
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2﹣歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2—、MnO4—、CO32—、SO42—、SiO32—中的若
干种组成(不考虑水的电离)。取该溶液进行如下实验:
Ⅰ.取适量溶液,加入过量的盐酸,有气体生成,并得到无色溶液;
Ⅱ.在Ⅰ所得溶液中加入过量的NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
Ⅲ.在Ⅱ所得溶液中加入过量的Ba(OH)2溶液,加热,也有气体生成,同时析出白色沉淀乙。
请回答下列问题:
(1)由实验Ⅰ可知原溶液中一定不含有的离子是________;一定含有的离子是________________。
(2)由实验Ⅱ可知原溶液中还一定含有的离子是________;生成甲的离子方程式为________________。
(3)实验Ⅲ中生成白色沉淀乙的离子方程式为________________。
(4)原溶液中还可能存在的离子是________;检验该离子的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工厂的工业废水,不可直接往江河湖海中排放,否则会造成严重公害。某河道两旁有甲、乙两厂,它们排出的工业废水各含有K+、Fe3+、Ba2+、Ag+、Cl-、SO42-、NO3-、OH-中的四种。又知甲厂污水pH>7。
(1)甲厂污水中含有的四种离子可能是:_______________________________。
(2)乙厂污水中含有的四种离子可能是:______________________________。
(3)对乙厂废水进行处理,方法之一,可往废水中加入一定量的________(选填
“活性碳”“硫酸亚铁”或“铁粉”),可以回收其中的金属__________(填
元素符号)。
(4)消除污染的另一种重要措施是将甲、乙两厂的废水按比例混合,可使废水中的________(填离子符号)转化为沉淀,从而大大降低污染程度。过滤后所得废水主要含________,可用于浇灌农田。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: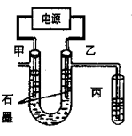
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH) 2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH) 2的Ksp=2.2×10-20)。
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-。该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO3—、SO42—、CO32—、HCO3—、MnO4—。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH4+。
将该白色粉末进行下列实验,观察到的现象如下:
| 实验操作 | 现象 |
| a.取少量粉末,加水、振荡 | 全部溶解、 |
| 溶液无色透明 | |
| b.向所得溶液中慢慢滴入苛性钠溶液,并加热 | 无明显现象 |
| c.取少量粉末,加盐酸 | 无明显现象 |
| d.取少量粉末,加稀H2SO4和稀HNO3的混合液 | 有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com