
将m g ![]() 与n g
与n g ![]() 分别加入100mL
分别加入100mL ![]() 的盐酸中。若反应后两种溶液的质量相等,则m与n的关系是
的盐酸中。若反应后两种溶液的质量相等,则m与n的关系是
A.m=n≤2.5
B.m=n>2.5
C.m=n≥5
D.m<n<2.5
科目:高中化学 来源:黄冈重点作业 高一化学(下) 题型:013
将m g 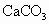 与n
g
与n
g  分别加入100ml 0.5mol/L的盐酸中,若反应后两种溶液的质量相等,则m与n的关系是
分别加入100ml 0.5mol/L的盐酸中,若反应后两种溶液的质量相等,则m与n的关系是
[ ]
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol?L-1,c(N)=2.4 mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2 mol?L-1,a = mol?L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热 (填“大于”、“等于”或“小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式为 。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应是 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,
P(g)+Q(g) ΔH>0,
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为 (填序号)。
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(3)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
得CO2和CH3OH(g)的浓度随时间变化如右图所示。
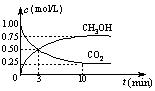
①从3 min到10 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.升高温度 B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,
P(g)+Q(g) ΔH>0,
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为 (填序号)。
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(3)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
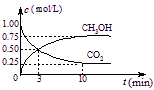 得CO2和CH3OH(g)的浓度随时间变化如右图所示。
得CO2和CH3OH(g)的浓度随时间变化如右图所示。
①从3 min到10 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.升高温度 B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入1 mol CO2和3 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com