
分析 ①电离出的阳离子全部是氢离子,且阴离子中含有氧元素的化合物叫做含氧酸;
②电离出的阳离子全部是氢离子,且阴离子中不含有氧元素的化合物叫做无氧酸;
③酸性氧化物是可以和碱反应生成盐和水的化合物;
④阴离子中含有氧元素的酸叫做含氧酸,氢氧化铁是难溶碱.
解答 解:①盐酸是无氧酸,可以和纯碱碳酸钠之间反应生成氯化钠、水以及二氧化碳;即2HCl+Na2CO3=2NaCl+CO2↑+H2O,故答案为:2HCl+Na2CO3=2NaCl+CO2↑+H2O;
②NaOH电离出的阴离子全部是氢氧根离子,属于碱,能和无氧酸盐酸之间反应,即HCl+NaOH=NaCl+H2O,故答案为:HCl+NaOH=NaCl+H2O;
③二氧化碳是酸性氧化物,可以和强碱氢氧化钠之间反应生成碳酸钠和水,即CO2+2NaOH=Na2CO3+H2O,故答案为:CO2+2NaOH=Na2CO3+H2O;
④硫酸是一种含氧酸,可以和难溶的碱氢氧化铁之间反应生成硫酸铁和水,即3H2SO4+2Fe(OH)3=Fe2(SO4)3+6H2O,故答案为:3H2SO4+2Fe(OH)3=Fe2(SO4)3+6H2O.
点评 本题考查根据物质的类别来书写化学式,以及物质的分类知识,学生应熟悉物质类别的概念,利用概念来选择元素形成符合要求的相应的化合物.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L NH4Cl溶液 | B. | 0.5mol/L盐酸 | ||
| C. | 0.5mol/LH2SO4 | D. | 0.5mol/L醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 6种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
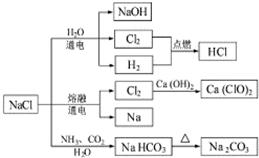 NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )
NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的小 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下液氯能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
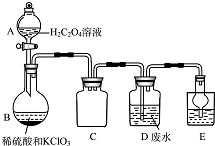 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| C. | 在合成氨的反应中,降温或加压有利于氨的合成 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com