
【题目】利用化合价推测物质的性质是化学研究的重要手段。
(1)![]() 的性质___________(填字母序号,下同)。
的性质___________(填字母序号,下同)。
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
(2)将![]() 通入酸性
通入酸性![]() 溶液中,溶液由紫色变成无色(
溶液中,溶液由紫色变成无色(![]() 元素以
元素以![]() 形式存在)。反应结束后,硫元素的存在形式合理的是_______________。
形式存在)。反应结束后,硫元素的存在形式合理的是_______________。
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
(3)将![]() 通入氯水中,因发生氧化还原反应生成
通入氯水中,因发生氧化还原反应生成![]() ,写出该反应的化学方程式____________。
,写出该反应的化学方程式____________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
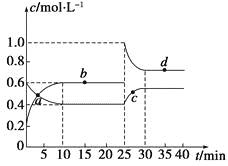
(1)该温度下,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解100mL的氯化钠溶液,当电路中通过1mole-时,阴阳两极产生的气体体积比为5:3,则原氯化钠溶液的物质的量浓度(mol/L)为( )
A.4B.2C.1D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A具有如下性质:
的有机物A具有如下性质:![]() 在浓硫酸作用下,发生分子内脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;
在浓硫酸作用下,发生分子内脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;![]() 在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;
在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;![]() 在浓硫酸作用下,能生成一种分子式为
在浓硫酸作用下,能生成一种分子式为![]() 的五元环状化合物E。下列叙述正确的是
的五元环状化合物E。下列叙述正确的是 ![]()
![]()
A.A的结构简式为![]()
B.C与D互为同系物
C.A转化为B的反应属于取代反应
D.B与E互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某可逆反应达到平衡,其平衡常数为K= ![]() ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
A.该反应的化学方程式为CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.升高温度,K值减小
C.升高温度,逆反应速率减小
D.该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验要求,从下列物质的分离或提纯方法中,选择恰当的实验方法将其序号填在空格处。
A.萃取分液 B.过滤 C.加热分解 D.蒸馏
(1)除去![]() 固体中少量的
固体中少量的![]() :_____________________。
:_____________________。
(2)分离食盐水与沙子的混合物:___________________。
(3)从碘水中提取碘:________________________。
(4)分离四氯化碳(沸点![]() )和甲苯(沸点
)和甲苯(沸点![]() )的混合物:___________________。
)的混合物:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ;②
;②![]() ;③(CH3)3C–CHBr2;④CHCl2–CHBr2;⑤
;③(CH3)3C–CHBr2;④CHCl2–CHBr2;⑤![]() ;⑥CH3Cl
;⑥CH3Cl
A.全部B.②④C.①③⑥D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的说法不正确的是( )
A.浓硝酸是一种易挥发的液体混合物
B.浓硝酸在空气中敞口放置,因吸收水蒸气而浓度减小
C.浓硝酸不稳定,易分解生成二氧化氮、氧气和水
D.常温下,浓硝酸常保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热炼镁还原渣[Al、Ca(AlO2)2、Al2O3、MgO及少量不能被碱液溶出的尖晶石型铝的化合物等]制取Al(OH)3的工艺流程如下:
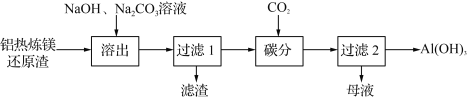
(1) “滤渣”成分包括:水合铝酸钙、尖晶石型铝的化合物、不含铝的化合物______________(写两种物质的化学式)。
(2) “溶出”时,在适当条件下,铝及其大部分含铝化合物以NaAlO2溶出。
①金属Al与NaOH溶液反应的化学方程式为________________________________。
②其他条件相同时,Na2CO3、NaOH溶液的浓度对铝的溶出率的影响如图所示:
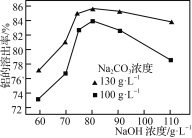
NaOH溶液浓度一定时,130 g·L-1的Na2CO3溶液对铝的溶出率比100 g·L-1的大,这是因为______________(从平衡移动角度分析);Na2CO3溶液浓度一定时,当NaOH溶液浓度大于80 g·L-1,铝的溶出率随NaOH溶液浓度增大而减小,可能原因是______________。
(3) “碳分”时,溶液与过量CO2反应的离子方程式为________________________。
(4) “过滤2”的母液经再生处理可返回“溶出”工序循环使用,再生的方法是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com