
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
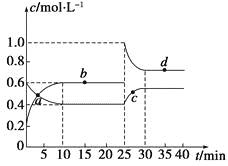
(1)该温度下,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是___________________________。
【答案】增大 bd 0.04 mol·L-1·min-1 0.8 mol NO2 小于 假设平衡时二氧化氮的浓度为0.8 mol·L-1,则此时Q=1.28>K=0.9,平衡要逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol·L-1
【解析】
(1)该反应为吸热反应,所以温度升高,K值增大,答案为增大;
(2)由图可知,10~25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态;由图可知从起点开始首次达到平衡时,以NO2表示的反应速率为(0.6-0.2)mol/L÷10min=0.04 mol·L-1·min-1;
(3)25min时,c(NO2)瞬间增大,比平衡状态增加了(1-0.6)mol/L×2L=0.8mol,增大c(NO2),平衡向生成N2O4方向移动;
(4)若平衡时二氧化氮的浓度为0.8 mol·L-1,则平衡时四氧化二氮的浓度是0.5mol/L,则此时Q=![]() =1.28>K=
=1.28>K=![]() =0.9,平衡要逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol·L-1 。
=0.9,平衡要逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol·L-1 。


科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学以废旧铝制易拉罐为原料制备Al(OH)3其流程如图:
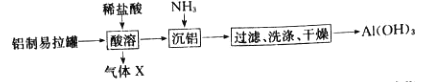
(1)“酸溶”时,增大盐酸的浓度反应速率将___(填“增大”或“减小”)。
(2)气体X是___(填“H2”或“CO2”)。
(3)一定条件下,将1molN2和3molH2置于lL密闭容器中合成NH3,10min后测得H2为l.2mol,则用H2表示该反应的速率为___molL-1min-1。
(4)氢氧化铝是___(从性质上分类)氢氧化物,它与盐酸反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L·min)。
xC(g)+2D(g),5 min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L·min)。
(1)B的反应速率v(B)=___,x=___。
(2)A在5 min末的浓度是_______。
(3)此时容器内的压强与开始时之比为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。
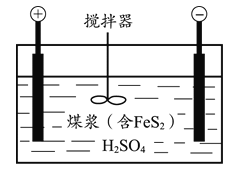
(1)将煤打成煤浆加入电解槽的目的是________。
(2)阳极的电极反应式为________。
(3)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:FeS2 +·OH =Fe3+ + SO42- + H2O +___。
(4)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如下图所示。

pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2![]() 2CO2+ 4H2O。下列说法不正确的是
2CO2+ 4H2O。下列说法不正确的是
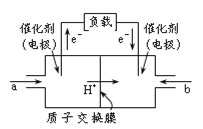
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为:O2+ 2H2O + 4e-= 4OH-
C.负极反应式为:CH3OH + H2O-6e- = CO2+ 6H+
D.该电池提供1mole-,消耗氧气0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
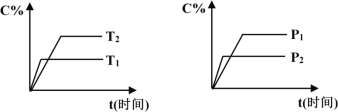
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中成药连花清瘟胶囊在对抗 H1N1病毒中发挥重大作用,其有效成分绿原酸的结构简式如图,下列有关说法错误的是

A. 绿原酸属于芳香族化合物
B. 分子中至少有 7 个碳原子共面
C. 1mol 绿原酸最多可消耗 5mol NaOH
D. 与绿原酸苯环上取代基种类及个数均相同的有机物有5 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化合价推测物质的性质是化学研究的重要手段。
(1)![]() 的性质___________(填字母序号,下同)。
的性质___________(填字母序号,下同)。
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
(2)将![]() 通入酸性
通入酸性![]() 溶液中,溶液由紫色变成无色(
溶液中,溶液由紫色变成无色(![]() 元素以
元素以![]() 形式存在)。反应结束后,硫元素的存在形式合理的是_______________。
形式存在)。反应结束后,硫元素的存在形式合理的是_______________。
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
(3)将![]() 通入氯水中,因发生氧化还原反应生成
通入氯水中,因发生氧化还原反应生成![]() ,写出该反应的化学方程式____________。
,写出该反应的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com