
| A. | 向某溶液中滴加KSCN溶液,变为血红色,则原溶液中含有Fe3+ | |
| B. | 向某溶液中滴加NaOH溶液,生成白色沉淀,继而变为灰绿色,最终变为红褐色,则原溶液中含有Fe2+ | |
| C. | 将淀粉和氯化钠的混合溶液装入半透膜中,将半透膜浸泡在盛有蒸馏水的烧杯中,为检验半透膜是否破损,可向蒸馏水中加入硝酸银溶液来验证 | |
| D. | 硫酸亚铁溶液中,常放入一些铁粉 |
分析 A.铁离子遇KSCN溶液为血红色;
B.白色沉淀,继而变为灰绿色,最终变为红褐色,可知白色沉淀为氢氧化亚铁;
C.胶体不能透过半透膜,检验半透膜是否破损,可检验烧杯中是否淀粉;
D.亚铁离子易被氧化.
解答 解:A.铁离子遇KSCN溶液为血红色,则某溶液中滴加KSCN溶液,变为血红色,则原溶液中含有Fe3+,故A正确;
B.白色沉淀,继而变为灰绿色,最终变为红褐色,可知白色沉淀为氢氧化亚铁,则原溶液中含有Fe2+,故B正确;
C.胶体不能透过半透膜,溶液可透过半透膜,检验半透膜是否破损,可检验烧杯中是否淀粉,则应向蒸馏水中加入碘水来验证,故C错误;
D.亚铁离子易被氧化,则硫酸亚铁溶液中,常放入一些铁粉,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握离子及物质检验、混合物分离提纯、试剂保存为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | |||
| W |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | 物质的量表示含有一定数目粒子的集体 | |
| C. | 物质的量是国际单位制中的一个基本单位 | |
| D. | 摩尔是计量原子、分子或离子等微观粒子的“物质的量”的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
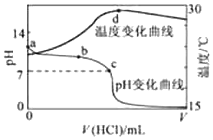 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A. | SO2的平衡转化率:α1>α2=α3 | B. | SO3的物质的量浓度:c(甲)=c(丁)<c(丙) | ||
| C. | 甲、乙中的平衡常数:K(甲)=K(乙)=400 | D. | 丙、丁中的平衡常数:K(丙)<K(丁) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com