
| A. | 2.5g | B. | 5.0g | C. | 7.5g | D. | 10.0g |
分析 盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl);用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2),据此结合m=nM计算得到的铁的质量,总质量减去铁的质量等于氧原的质量,而二氧化碳的物质的量等于氧原子的物质的量,等于沉淀的物质的量,由此分析解答.
解答 解:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.2L×1mol/L=0.1mol;
用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.1mol,质量为0.1mol×56g/mol=5.6g,所以氧原子的物质的量为:6.4g-5.6g=0.8mol,所以氧原子的物质的量为:$\frac{0.8mol}{16mol/L}$=0.05mol,也就是碳酸钙的物质的量为0.05mol,所以沉淀的质量为:0.05mol×100g/mol=5g,故选B.
点评 本题考查混合物的计算,难度中等,利用元素守恒判断铁的物质的量是解题关键,注意守恒思想的运用.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 改用98%的浓硫酸 | ||
| C. | 改用锌粒 | D. | 滴加少量CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
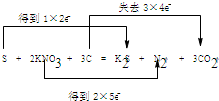
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | H2Te>H2Se>H2S>H2O | ||
| C. | MgO>NaCl>H2O>HF | D. | 金刚石>生铁>纯铁>钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的c(H+)=1×10-12mol•L-1的溶液:Mg2+、SO42-、NO3-、Cl- | |
| B. | 含有大量Fe3+的溶液:K+、Na+、AlO2-、SO42- | |
| C. | 能使pH试纸变红的溶液:NH4+、Na+、NO3-、HCO3- | |
| D. | 含有大量S2-的溶液:Na+、ClO-、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的非金属性强于W | |
| B. | X与Y可形成的离子化合物不止一种 | |
| C. | W元素最高价氧化物对应水化物的化学式为H2WO4 | |
| D. | Y、Z的简单离子都能破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10mL0.1mol•L-1CH3COONa溶液与6mL0.2mol•L-1的盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CHC3OO-)-c(CHC3OOH) | |
| C. | 0.1mol•L-1NH4HSO4溶液与0.1mol•L-1NaOH溶液等体积混合:c(Na+)=c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1HCN溶液与0.05mol•L-1NaOH溶液等体积混合(pH>7):c(HCN)+c(H+)>c(OH-)+c(CN-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com