
| A、W、X、Y、Z的原子半径大小顺序是X>Y>Z>W |
| B、元素Y的简单气态氢化物的热稳定性比X的强 |
| C、含上述四种元素的化合物一定易溶于水 |
| D、含上述四种元素的化合物可能既能与酸反应又能与碱反应 |


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol/L HX溶液的pH值约为2 |
| B、HX能与水以任意比例互溶 |
| C、10 mL 1mol/L HX恰好与10 mL l mol/L NaOH溶液完全反应 |
| D、HX溶液的导电性比强酸溶液的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
| B、CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 |
| C、饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变 |
| D、25℃时Cu(OH)2在水中的溶解度小于其在Cu(NO3)2溶液中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
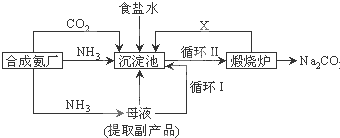
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上常用稀硫酸除铁锈 |
| B、水壶中的水垢常用食盐水来清洗 |
| C、炉具清洁剂中的氢氧化钠具有强烈的腐蚀性 |
| D、碳酸钠俗称纯碱,常用于玻璃、造纸、洗涤剂的生产 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com