


科目:高中化学 来源:不详 题型:单选题
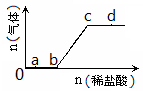
| A.a点对应的溶液中:Na+、OH-、SO42-、NO3- |
| B.b点对应的溶液中:Al3+、Fe3+,MnO4-、Cl- |
| C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
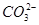 、
、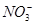 、
、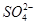 、
、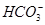 、
、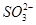 中的若干种离子。某同学对该溶液进行如下实验:
中的若干种离子。某同学对该溶液进行如下实验: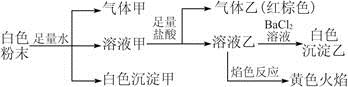
A.白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和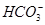 |
| B.气体乙一定是NO和NO2的混合气体 |
C.白色沉淀乙是BaSO4,所以原混合物一定含有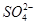 |
| D.焰色反应为黄色火焰,不能确定原混合物中不含K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | 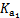 =4.3×10-7 =4.3×10-7 | 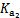 =5.6×10-11 =5.6×10-11 | Ka=3.0×10-8 |
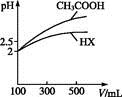
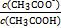 = 。
= 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: HZ<HY< HX |
| B.在HZ中加入NaOH至恰好完全反应时,溶液中各离子浓度大小顺序: c(Na+)>c(Z-)>c(OH—)>c(H+) |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)+c(Y—)+c(OH—)= c(Na+)+c(H+) |
| D.将HX和HZ溶液混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)= c(X—)+ c(Z—) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+) |
| B.能使紫色石蕊试液呈红色的溶液:Na+、NH、I-、NO可以大量共存 |
| C.任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| D.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-= CO32- + H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.K+、Na+、HSO 、Cl- 、Cl- |
B.Na+、Ba2+、[Al(OH)4]-、NO |
C.NH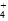 、K+、Cl-、NO 、K+、Cl-、NO |
| D.Fe2+、Na+、ClO-、S2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42- |
| B.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO- |
| C.能使pH试纸变红的溶液中:K+、Ba2+、AlO2-、Cl- |
| D.pH=0的溶液中:Mg2+、Na+、F-、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO3— | B.CO32—、NO3— |
| C.SO32—、NO3— | D.CO32—、NO3—、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com