

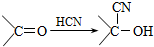

 ):
):
 、I为
、I为 .结合反应信息(2)可知H为
.结合反应信息(2)可知H为 ,G发生信息反应(3)生成H,则G为
,G发生信息反应(3)生成H,则G为 .
. ,C发生信息(1)中第1步反应生成D,D与CH3CHCHCH3在50%氢氧化钠条件下反应生成E,根据E的结构可知,D为
,C发生信息(1)中第1步反应生成D,D与CH3CHCHCH3在50%氢氧化钠条件下反应生成E,根据E的结构可知,D为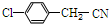 ,C为
,C为 ,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为
,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为 ,B为
,B为 ,据此解答.
,据此解答. 、I为
、I为 .结合反应信息(2)可知H为
.结合反应信息(2)可知H为 ,G发生信息反应(3)生成H,则G为
,G发生信息反应(3)生成H,则G为 .
. ,C发生信息(1)中第1步反应生成D,D与CH3CHCHCH3在50%氢氧化钠条件下反应生成E,根据E的结构可知,D为
,C发生信息(1)中第1步反应生成D,D与CH3CHCHCH3在50%氢氧化钠条件下反应生成E,根据E的结构可知,D为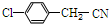 ,C为
,C为 ,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为
,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为 ,B为
,B为 ,
, ,名称为甲苯,由反应物及G的结构可知合成G的反应属于取代反应,故答案为:甲苯;取代反应;
,名称为甲苯,由反应物及G的结构可知合成G的反应属于取代反应,故答案为:甲苯;取代反应;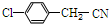 +CH3CHClCH3+NaOH→NaCl+H2O+
+CH3CHClCH3+NaOH→NaCl+H2O+ ,
,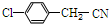 +CH3CHClCH3+NaOH→NaCl+H2O+
+CH3CHClCH3+NaOH→NaCl+H2O+ ;
; 互为同分异构体,且X是萘(
互为同分异构体,且X是萘( 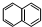 )的一-C≡CC(NH2)COOH,取代物,含有碳碳叁键,侧链为-C≡CCH(NH2)COOH,或-CH(NH2)C≡CCOOH,或-CH(COOH)C≡CNH2,或-C(NH2)(COOH)C≡CH,萘分子中只有2种H原子,故符合条件的同分异构体共有8种,其中一种为X为
)的一-C≡CC(NH2)COOH,取代物,含有碳碳叁键,侧链为-C≡CCH(NH2)COOH,或-CH(NH2)C≡CCOOH,或-CH(COOH)C≡CNH2,或-C(NH2)(COOH)C≡CH,萘分子中只有2种H原子,故符合条件的同分异构体共有8种,其中一种为X为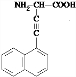 ,X通过肽键连接而成的高聚物Y的结构简式是
,X通过肽键连接而成的高聚物Y的结构简式是 ,
, .
.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
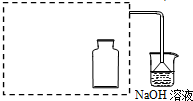
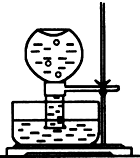 (1)如图所示,现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是(请用相关的反应方程式和简要文字说明)
(1)如图所示,现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是(请用相关的反应方程式和简要文字说明)查看答案和解析>>
科目:高中化学 来源: 题型:
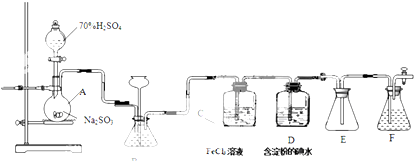
| 操作 | 现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热. |  |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中. | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.4mol/L |
| B、0.2mol/L |
| C、1.8mol/L |
| D、3.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、45kJ |
| B、436kJ |
| C、1308kJ |
| D、135kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com