


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
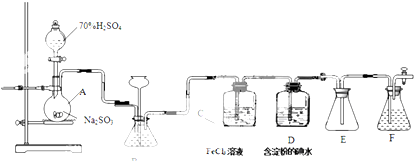
 用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )| 选项 | 气体 | a | b | c | d |
| A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO3溶液 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立; 若未出现血红色,则假设2或假设3成立. |
| 步骤2: | 结合步骤1的现象和结论, |
查看答案和解析>>
科目:高中化学 来源: 题型:
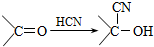
 ,有机物甲的结构简式为
,有机物甲的结构简式为 ,它是由不饱和烃乙的两个分子在一定条件下自身加成得到,在此反应中除生成甲外,还同时生成另一种产量更高的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体.
,它是由不饱和烃乙的两个分子在一定条件下自身加成得到,在此反应中除生成甲外,还同时生成另一种产量更高的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体.查看答案和解析>>
科目:高中化学 来源: 题型:


 ):
):
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、蒸发 |
| D、蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口附近 |
| B、蒸发操作时,应使混合物的水分完全蒸干后才能停止加热 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,应选择有机萃取剂,它与原溶剂应互不相溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com