
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ||||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
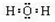 ,可与钾发生反应生成氢氧化钾和氢气,反应的离子方程式为2K+2H2O═2K++2OH-+H2↑,
,可与钾发生反应生成氢氧化钾和氢气,反应的离子方程式为2K+2H2O═2K++2OH-+H2↑,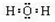 ; 2K+2H2O═2K++2OH-+H2↑;
; 2K+2H2O═2K++2OH-+H2↑;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、NH4Br的电子式: | ||
B、S原子的结构示意图: | ||
| C、乙醇的结构简式:C2H6O | ||
D、原子核内有18个中子的氯原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
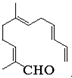 从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )
从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D元素原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F位于周期表的第七列 |
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置组成一种原电池.试回答下列问题:
如图所示装置组成一种原电池.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.CO(g)的燃烧热△H为-283.0kJ?mol-1,已知1mol甲醇(CH3OH)完全燃烧放出热量为726.5kJ.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.CO(g)的燃烧热△H为-283.0kJ?mol-1,已知1mol甲醇(CH3OH)完全燃烧放出热量为726.5kJ.请回答下列问题:| nA |
| lA |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.| B | D | |
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:


 和
和 ,鉴别I和J的试剂为
,鉴别I和J的试剂为查看答案和解析>>
科目:高中化学 来源: 题型:


| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 | 滤液A中有Fe3+ | |
| 步骤2:在滤液A中加入 | 滤液A中有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com