
【题目】氮化铝( AlN)广泛应用于电子、陶瓷工业等领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C![]() 2AlN+3CO。下列叙述正确的是( )
2AlN+3CO。下列叙述正确的是( )
A.AlN中氮的化合价为+3
B.AlN的摩尔质量为41 g
C.上述反应中,N2是氧化剂,Al2O3既不是氧化剂也不是还原剂。
D.上述反应中,每生成1 mol AlN需转移6 mol电子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体、难溶于CCl4。实验室可将干燥二氧化碳和氨气通入CCl4中进行制备,反应原理为2NH3(g)+CO2(g)=NH2COONH4(s) △H<0,回答下列问题:
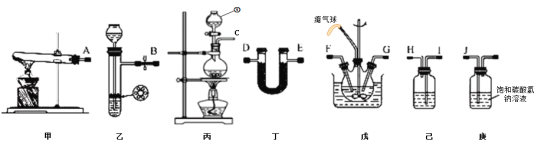
(1)仪器①的名称为_____,装置己中盛放的试剂为_____。
(2)简述检验装置乙气密性的操作_____。
(3)氨气的发生装置可以选择上图中的_____,制取氨气的化学方程式为_____。
(4)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→_____→FG←_____←KJ←_____(按气流方向,用大写字母表示)。
(5)为了提高氨基甲酸铵的产率.对三颈瓶采取的控温方法是_____,反应结束后,从反应后的混合物中分离出产品的实验操作是_____,戊中气球的作用是_____。
(6)氨基甲酸铵容易变质生成碳酸氢铵,现取长期存放的样品19.550g,用足量石灰水处理后,使样品中碳元素完全转化为碳酸钙,通过系列操作得纯净碳酸钙25.000g,则该样品的纯度为_____%。(计算结果保留三位有效数字;有关物质的相对式量:氨基甲酸铵78、碳酸氢铵79、碳酸钙100) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.100 g46%的甲酸水溶液中所含的氧原子数目为 5NA
B.常温下,1L pH=7 的 lmolL-1 CH3COONH4 溶液中 CH3COO-与![]() 数目均为NA
数目均为NA
C.11 g由![]() H和
H和![]() O组成的超重水中,含有的中子数目为 5NA
O组成的超重水中,含有的中子数目为 5NA
D.高温下 ,5.6gFe 与足量的水蒸气反应,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下.某同学进行CO2与Na2O2反应的探究实验(本实验所涉及气体休积均在相同状况下测定)。请回答下列问题:
(1)用下图装置制备纯净的CO2.
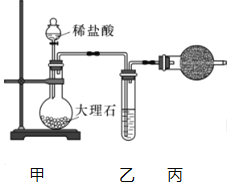
①丙装置的名称是_______,乙装置中盛装的试剂是_______.
②若CO2中混有HCl,则HCl与Na2O2发生反应的化学方程式为_________。
(2)按下图所示装置进行实验(夹持装置略)。
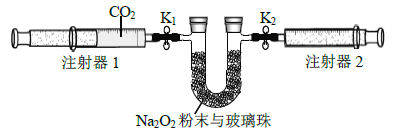
①先组装仪器.然后________.再用注射器1抽取100 mL纯净的CO2,将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞。可观察到的现象是________。
③实验过程中.需缓慢推入CO2,其目的是__________.为达到相同目的,还可进行的操作是__________________________。
(3)实验结束后,当注射器1的活塞推到底时,测得注射器2中气体的体积为65 mL。则CO2的转化率是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
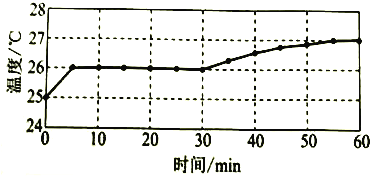
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
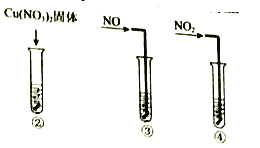
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是
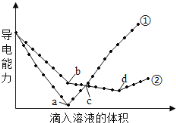
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是_________,被还原的元素是________;
(2)氧化剂与还原剂的物质的量之比是_________________;
(3)用双线桥法分析上述反应的电子转移方向和数目____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于H2+Cl2![]() 2HCl反应下列说法不正确的是( )
2HCl反应下列说法不正确的是( )
A.反应过程中既有化学键断裂又有化学键形成
B.在反应物分子内共价键断裂,生成物分子内形成共价键
C.反应过程中断裂的化学键是非极共价键,形成的化学键是极性共价键
D.生成物HCl溶解于水中,离子键被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L恒容密闭容器中加入1molNO和1molO3,发生反应![]() 。在不同温度下,分别测定体系中NO2的百分含量
。在不同温度下,分别测定体系中NO2的百分含量![]() 随反应时间的变化如图。
随反应时间的变化如图。
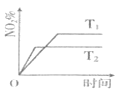
(1)T1______![]() ,
,![]() ______0,
______0,![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 理由是______;
理由是______;
(2)温度为![]() 时,反应2min时达到平衡状态。测得2min内,
时,反应2min时达到平衡状态。测得2min内,![]() ,则平衡时NO的转化率
,则平衡时NO的转化率![]() ______;
______;
(3)下列情况能表明该反应达到平衡状态的是______![]() 填代号
填代号![]() ;
;
A. NO消耗速率等于![]() 的生成速率 B.
的生成速率 B. ![]() :
:![]() :1
:1
C. 气体密度保持不变 D. 容器内气体颜色不再变化
(4)该反应达到平衡后,为加快反应速率同时提高NO的转化率,可采取的措施有______![]() 填标号
填标号![]()
A.使用高效催化剂 B.升高温度 C.再充人一定量的![]() D.缩小容器的体积
D.缩小容器的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com