
【题目】向2L恒容密闭容器中加入1molNO和1molO3,发生反应![]() 。在不同温度下,分别测定体系中NO2的百分含量
。在不同温度下,分别测定体系中NO2的百分含量![]() 随反应时间的变化如图。
随反应时间的变化如图。
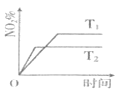
(1)T1______![]() ,
,![]() ______0,
______0,![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 理由是______;
理由是______;
(2)温度为![]() 时,反应2min时达到平衡状态。测得2min内,
时,反应2min时达到平衡状态。测得2min内,![]() ,则平衡时NO的转化率
,则平衡时NO的转化率![]() ______;
______;
(3)下列情况能表明该反应达到平衡状态的是______![]() 填代号
填代号![]() ;
;
A. NO消耗速率等于![]() 的生成速率 B.
的生成速率 B. ![]() :
:![]() :1
:1
C. 气体密度保持不变 D. 容器内气体颜色不再变化
(4)该反应达到平衡后,为加快反应速率同时提高NO的转化率,可采取的措施有______![]() 填标号
填标号![]()
A.使用高效催化剂 B.升高温度 C.再充人一定量的![]() D.缩小容器的体积
D.缩小容器的体积
【答案】< < 温度为![]() 时,反应达到平衡所需时间短,速率快,则温度高;温度越高,
时,反应达到平衡所需时间短,速率快,则温度高;温度越高,![]() 越小,说明升高温度反应逆向移动,所以正反应放热,
越小,说明升高温度反应逆向移动,所以正反应放热,![]() 64% AD C
64% AD C
【解析】
(1)升高温度,反应速率增大,达到平衡用时较少,则由横坐标可知T2较大;由纵坐标可知升高温度NO2%减小;
(2)由化学反应速率公式![]() 计算NO的转化量,再计算转化率;
计算NO的转化量,再计算转化率;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(4)化学反应NO(g)+O3(g)NO2(g)+O2(g)是反应前后气体物质的量不变的反应,且正反应为放热反应,为加快反应速率同时提高NO的转化率,即提高反应速率同时平衡正向移动,结合化学平衡移动原理和反应特征分析判断。
(1)温度为![]() 时,反应达到平衡所需时间短,速率快,则温度高,即T1<
时,反应达到平衡所需时间短,速率快,则温度高,即T1<![]() ;温度越高,
;温度越高,![]() 越小,说明升高温度反应逆向移动,所以正反应放热,
越小,说明升高温度反应逆向移动,所以正反应放热,![]() ;
;
故答案为:<;<;温度为![]() 时,反应达到平衡所需时间短,速率快,则温度高;温度越高,
时,反应达到平衡所需时间短,速率快,则温度高;温度越高,![]() 越小,说明升高温度反应逆向移动,所以正反应放热,
越小,说明升高温度反应逆向移动,所以正反应放热,![]() ;
;
(2)由化学反应速率![]() ,得
,得![]() ,则平衡时NO的转化率
,则平衡时NO的转化率![]() ;
;
故答案为:64%;
(3)A. NO消耗速率表示正反应速率,O3的生成速率表示逆反应速率,二者相等,表示正逆反应速率之比等于其化学计量数之比,说明反应到达平衡,A项正确;
B. ![]() :
:![]() :1,并不能说明两者的浓度不变,所以不一定达平衡状态,B项错误;
:1,并不能说明两者的浓度不变,所以不一定达平衡状态,B项错误;
C. 在2L恒容密闭容器中,混合气体总质量不变,容器容积不变,容器中气体的密度始终不变,所以不一定达到平衡状态,C项错误;
D. 容器内气体颜色不再变化,说明臭氧、二氧化氮的浓度不变,反应到达平衡,D项正确;
故答案为:AD;
(4)化学反应NO(g)+O3(g)NO2(g)+O2(g)是反应前后气体物质的量不变的反应,且△H<0,
A. 改用高效催化剂,增大反应速率,但不改变化学平衡,转化率不变,A项错误;
B. 反应为放热反应,升高温度平衡逆向进行,反应速率增大,但转化率减小,B项错误;
C. 再充人一定量的O3,增加O3的浓度,反应速率增大,平衡正向移动,可提高NO的转化率,C项正确;
D. 该反应是反应前后气体物质的量不变的反应,缩小容器的体积,增大压强,反应速率增大,但平衡不移动,反应物转化率不变,D项错误;
故答案为:C。


科目:高中化学 来源: 题型:
【题目】氮化铝( AlN)广泛应用于电子、陶瓷工业等领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C![]() 2AlN+3CO。下列叙述正确的是( )
2AlN+3CO。下列叙述正确的是( )
A.AlN中氮的化合价为+3
B.AlN的摩尔质量为41 g
C.上述反应中,N2是氧化剂,Al2O3既不是氧化剂也不是还原剂。
D.上述反应中,每生成1 mol AlN需转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得产物,即原子的利用率为100%.在用丙炔合成甲基丙烯酸甲酯![]() 的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是
的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是
A. CH2=CH2和CO B. CO和CH3OH C. CH3OH和H2 D. CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如右图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三种元素的名称________、________、________。
(2)B位于元素周期表中第________周期________族。
(3)C的原子结构示意图为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、用如图仪器组装成一套简易量热计测定室温下中和反应的反应热。
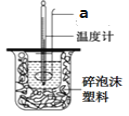
(1)碎泡沫塑料的作用是__________;图中仪器a的名称是____________;
(2)中和反应的实质是_______________(用离子方程式表示)。
Ⅱ、.某研究性学习小组的同学对Zn、Cu、稀硫酸组成的原电池进行了探究,其中甲同学利用下图I装置进行探究,乙同学经过查阅资料后设计了图II装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
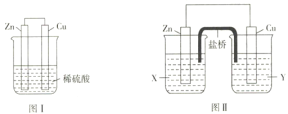
(3)实验表明,图I中两个电极上均有气泡产生,锌电极上有气泡产生,说明反应中有一部分化学能转化为_____能;铜电极上有气泡产生,说明反应中有一部分化学能转化为____能。
(4)图II中的X、Y是ZnSO4溶液及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X是_________,正极上的电极反应式为__________。
(5)当图I装置的溶液质量增加63g时,生成的氢气共有______L(标准状况;当图II中锌电极质量减少65g时,电路中转移的电子数为______NA。
Ⅲ、在一定条件下甲烷也可用于燃料电池。下图是甲烷燃料电池的原理示意图:

(6)若正极的反应式为O2+4e-+4H+=2H2O,则负极反应式为___________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com