
【题目】在一定温度下,将一定质量的混合气体在密闭容器内发生反应aA(g)+bB(g) ![]() cC(s)+dD(g),达到平衡时测得B气体的浓度为0.6 mol·L-1,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得气体B气体的浓度为0.4 mol·L-1,下列叙述正确的是
cC(s)+dD(g),达到平衡时测得B气体的浓度为0.6 mol·L-1,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得气体B气体的浓度为0.4 mol·L-1,下列叙述正确的是
A. a+b>c+d B. 平衡向右移动
C. 重新达平衡,A气体浓度增大 D. 重新达平衡时,B的体积分数增大
【答案】D
【解析】分析:保持温度不变,将容器的体积扩大1倍,若平衡不移动,B气体的浓度为0.3mol/L,实际B的浓度变为0.4mol/L,说明平衡向生成B的方向移动,即向逆反应方向移动。
详解:A. 生成物C为固体,增大体积,压强减小,平衡向逆反应方向移动,因压强减小平衡向气体物质的量增大的方向移动,即a+b>d,但a+b不一定大于c+d,故A错误;
B. 由上述分析可知,恒温下将密闭容器的容积扩大一倍,平衡向逆反应方向移动,即向左移动,故B错误;
C. 恒温下将密闭容器的容积扩大一倍,各物质的浓度都要减小,即A气体浓度减小,故C错误;
D. 因恒温下扩大容器的体积平衡逆向移动,则B气体的体积分数增大,故D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目________________________________。
(2)上述反应中氧化剂是______(填化学式),被氧化的元素是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断不正确的是

A. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
B. 该反应的化学方程式为3Z ![]() 3X+2Y
3X+2Y
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
D. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如下图,关于该有机物的空间构型下列说法中正确的是( )
![]()
A. 该分子中一定共面的碳原子数至少为8个
B. 该分子中所有的碳原子均可能处于同一平面上
C. 该分子中至少有9个碳原子处于同一条直线上
D. 该分子中处于同一平面的的原子总数最多为16个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y原子序数是X的2倍。下列说法不正确的是
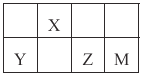
A. Z、M、X的简单离子半径依次减小
B. Y和M可形成离子化合物YM4
C. X的简单气态氢化物的稳定性强于Y的
D. M的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将0.5 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为_______________。又已知:H2O(g)=H2O(l) ΔH2=-44.0 kJ·mol-1,则4.48 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________。
(2)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体。已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/ (kJ·mol-1) | 348 | 413 | 436 | 358 | 1 072 | 458 |
则工业制备甲醇的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列各实验装置的叙述中,不正确的是
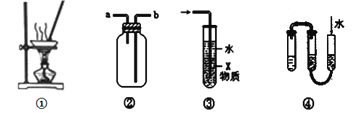
A. 装置①可用蒸发操作,蒸干FeSO4溶液获取FeSO4·7H2O晶体
B. 装置②可用于收集H2、Cl2、SO2、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④所示方法可检查该装置的气密性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N-苯基苯甲酰胺 ![]() 广泛应用于药物,可由苯甲酸
广泛应用于药物,可由苯甲酸![]() 与苯胺
与苯胺 ![]() 反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。已知:
反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。已知:
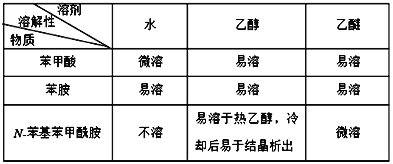
下列说法不正确的是
A. 反应时断键位置为C-O键和N-H键 B. 微波催化能减少该反应的热效应
C. 产物可选用乙醇作为溶剂进行重结晶提纯 D. 硅胶吸水,能使反应进行更完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学研究表明,姜黄素具有降血脂、抗肿瘤、消炎、抗氧化等作用。姜黄素的合成路线如下所示:

已知信息:
①1mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为3mol、2mol、1mol。

请回答下列问题:
(1)C物质的名称是_____________;J物质的分子式为______________;E到G的反应类型为______________。
(2)B中官能团的名称为_____________________;E物质的结构简式为________________。
(3)D与银氨溶液反应,再酸化可生成E;请写出此氧化过程的化学方程式:_____________________________________。
(4)写出2mol K物质和1mol![]() 转换为姜黄素的化学反应方程式:_____________________________________。
转换为姜黄素的化学反应方程式:_____________________________________。
(5)K的同分异构体中符合下列信息:
①含有苯环; ②苯环上只有两个支链; ③遇FeCl3溶液变色; ④含有![]() 结构。
结构。
符合上述条件的K的同分异构体有_____________________种。
(6)有机物L( )是一种重要的有机化合物。参照上述合成路线,补全以甲苯、
)是一种重要的有机化合物。参照上述合成路线,补全以甲苯、![]() 为有机原料制备L的合成路线流程图(无机试剂任用) ___________。
为有机原料制备L的合成路线流程图(无机试剂任用) ___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com