
����Ŀ��ҽѧ�о������������ؾ��н�Ѫ֬�������������ס������������á������صĺϳ�·��������ʾ��

��֪��Ϣ��
��1mol G���������Na��NaOH��NaHCO3�����ʵ����ֱ�Ϊ3mol��2mol��1mol��

��ش��������⣺
��1��C���ʵ�������_____________��J���ʵķ���ʽΪ______________��E��G�ķ�Ӧ����Ϊ______________��
��2��B�й����ŵ�����Ϊ_____________________��E���ʵĽṹ��ʽΪ________________��
��3��D��������Һ��Ӧ�����ữ������E����д�����������̵Ļ�ѧ����ʽ��_____________________________________��
��4��д��2mol K���ʺ�1mol![]() ת��Ϊ�����صĻ�ѧ��Ӧ����ʽ��_____________________________________��
ת��Ϊ�����صĻ�ѧ��Ӧ����ʽ��_____________________________________��
��5��K��ͬ���칹���з���������Ϣ��
�ٺ��б����� �ڱ�����ֻ������֧���� ����FeCl3��Һ��ɫ�� �ܺ���![]() �ṹ��
�ṹ��
��������������K��ͬ���칹����_____________________�֡�
��6���л���L( )��һ����Ҫ���л���������������ϳ�·�ߣ���ȫ�Լױ���
)��һ����Ҫ���л���������������ϳ�·�ߣ���ȫ�Լױ���![]() Ϊ�л�ԭ���Ʊ�L�ĺϳ�·������ͼ(���Լ�����) ___________��
Ϊ�л�ԭ���Ʊ�L�ĺϳ�·������ͼ(���Լ�����) ___________��
���𰸡� �Ҷ��� C9H8O5 �ӳɷ�Ӧ ��ԭ�� ![]()
![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH ![]()
![]() +2Ag ��+3NH3 +H2O
+2Ag ��+3NH3 +H2O 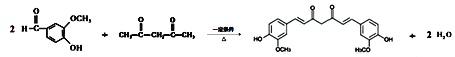 12
12 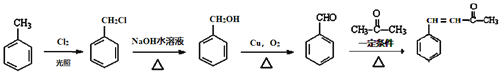
����������ϩ���巢���ӳɷ�Ӧ����BΪBrCH2CH2Br����B��Eת����D��E����ʽ��֪��E�к����Ȼ���D�����õ�E����D�к���-CHO��B����������ˮ��Һ�����������·���ˮ�ⷴӦ����CΪHOCH2CH2OH��DΪOHC-CHO��D�в���ȩ������������EΪOHC-COOH��1molG���������Na��NaOH��NaHCO3�����ʵ����ֱ�Ϊ3mol��2mol��1mol�����J�Ľṹ��֪��E��ȩ�������ӳ�����GΪ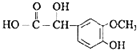 ��G�е�ȩ������������J��J��һ�������·�����Ϣ�����ȷ�Ӧ��������ȩKΪ
��G�е�ȩ������������J��J��һ�������·�����Ϣ�����ȷ�Ӧ��������ȩKΪ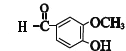 �������Ϣ�ۼ������صķ���ʽ����֪�����صĽṹ��ʽΪ��
�������Ϣ�ۼ������صķ���ʽ����֪�����صĽṹ��ʽΪ�� ���ݴ˽����
���ݴ˽����
��1�������Ͽ�֪C������Ϊ���Ҷ�����J���ʵķ���ʽΪC9H8O5��E��G�ķ�Ӧ����Ϊ���ӳɷ�Ӧ��
��2����������֪B�Ĺ�����Ϊ����ԭ�ӣ�E�Ľṹ��ʽΪ�� ![]() ��
��
��3��D��������Һ��Ӧ������ȩ�������������ữ���Ϊ�Ȼ����������̵ķ���ʽΪ��![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH ![]()
![]() +2Ag ��+3NH3 +H2O
+2Ag ��+3NH3 +H2O
��4��
��5��KΪ �����������ٺ��б������ڱ�����ֻ������֧��������FeCl3��Һ��ɫ��˵���з��ǻ����ܺ���
�����������ٺ��б������ڱ�����ֻ������֧��������FeCl3��Һ��ɫ��˵���з��ǻ����ܺ���![]() �ṹ��˵�������������Ȼ���ͬ����������K��ͬ���칹��Ϊ����������-OH����һ��ȡ����Ϊ-CH2OOCH����-COOCH3����-OOCCH3����-CH2COOH��ÿ��������ڼ���������������12��ͬ���칹�塣
�ṹ��˵�������������Ȼ���ͬ����������K��ͬ���칹��Ϊ����������-OH����һ��ȡ����Ϊ-CH2OOCH����-COOCH3����-OOCCH3����-CH2COOH��ÿ��������ڼ���������������12��ͬ���칹�塣
��6�� 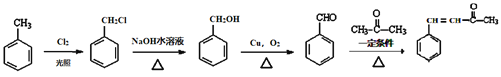


 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ�������Ļ���������ܱ������ڷ�����ӦaA(g)+bB(g) ![]() cC��s��+dD(g)���ﵽƽ��ʱ���B�����Ũ��Ϊ0.6 mol��L��1�������½��ܱ��������ݻ�����һ�������´ﵽƽ��ʱ���������B�����Ũ��Ϊ0.4 mol��L��1������������ȷ����
cC��s��+dD(g)���ﵽƽ��ʱ���B�����Ũ��Ϊ0.6 mol��L��1�������½��ܱ��������ݻ�����һ�������´ﵽƽ��ʱ���������B�����Ũ��Ϊ0.4 mol��L��1������������ȷ����
A. a+b>c+d B. ƽ�������ƶ�
C. ���´�ƽ�⣬A����Ũ������ D. ���´�ƽ��ʱ��B�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ��ˮ������������(����)
A.Cl2+H2O�THCl+HClOB.2F2+2H2O�T4HF+O2
C.2Na+2H2O�T2NaOH+H2��D.CaO+H2O�TCa(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mL�Ȼ�þ���Ȼ����Ļ��Һ�У�Mg2+�����ʵ���Ũ��Ϊ0.2mol��L1��Cl�����ʵ���Ũ��Ϊ1.3mol��L1��ҪʹMg2+ȫ��ת��Ϊ�������������������Ҫ����4mol��L1NaOH��Һ�����Ϊ�� ��
A. 40mLB. 72mLC. 80mLD. 128mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽����ҵ�к�����������ͭ�ĺϽ���ϵ������ã�ijͬѧ��������»��շ�����
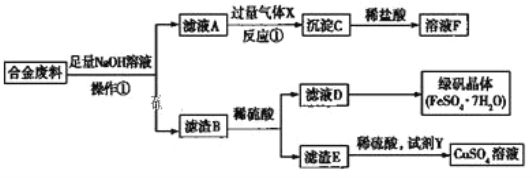
![]() ����
����![]() ��������___________������B����_______________________ ���ѧʽ����
��������___________������B����_______________________ ���ѧʽ����
![]() �Ͻ������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��____________________________________��
�Ͻ������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��____________________________________��
![]() ��Ӧ
��Ӧ![]() �����ӷ���ʽ��___________________________________��
�����ӷ���ʽ��___________________________________��
![]() ��Ҫ����ҺD�еõ��̷����壬������е�ʵ�������_____________����ȴ�ᾧ�����ˡ�ϴ�ӡ��������һϵ�в�����û���õ���������_________________������ţ���
��Ҫ����ҺD�еõ��̷����壬������е�ʵ�������_____________����ȴ�ᾧ�����ˡ�ϴ�ӡ��������һϵ�в�����û���õ���������_________________������ţ���
A��©��![]() ����
����![]() �ձ�
�ձ�![]() ������
������
![]() �Լ�YӦ����һ��____________��������������������ԭ������������������______������ţ���
�Լ�YӦ����һ��____________��������������������ԭ������������������______������ţ���
A��H2O2 B��H2 C��O2 D��Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ����ɫ���壬T��RΪ���ֳ�������;�ܹ�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬C����ɫ��ζ�����壬H�ǰ�ɫ���������ڳ�ʪ������Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ���塣

��1��д���������ʵĻ�ѧʽ��A��__________��D��___________��R��_____________��
��2����Ҫ��д���з�Ӧ����ʽ��
H�ڳ�ʪ�����б��M�Ĺ����еĻ�ѧ����ʽ______________________________��
B��Q��Ӧ�����ӷ���ʽ_________________________________________��
D��ϡ���ᷴӦ�����ӷ���ʽ______________________________________________��
��3��������ҺN�������ӵķ������������ӷ���ʽΪ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�д����������������(����)
A.���д���Al3+����Һ��Na+��SO42����Cl��
B.��ʹ��̪������Һ��Na+��Ca2+��CO32��
C.���д���Fe3+����Һ��OH����Mg2+��Cl��
D.���д���HCO3������Һ��H+��SO42����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���᳧�����¼��ַ�������SO2β����
(1)�����������շ�
�� Na2SO3��Һ����SO2�����ӷ���ʽΪ_______________����������Һ������Ũ���ɴ�С������˳��Ϊ______________��
�� �����£���������pH=6ʱ������Һ���������Ũ�ȹ�ϵһ����ȷ����_______
(�����)
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-��+C(H2SO3)
c.c(Na+)>c(SO32-)>c(OHһ)>c(H+)
d.ˮ�����c(OHһ)=1��l0-8mol/L
��25 ��ʱ��H2SO3![]() HSO
HSO![]() ��H���ĵ��볣��Ka��1��10��2mol��L��1������¶���NaHSO3ˮ�ⷴӦ��ƽ�ⳣ��Kh��______mol��L��1������NaHSO3��Һ�м���������I2������Һ��
��H���ĵ��볣��Ka��1��10��2mol��L��1������¶���NaHSO3ˮ�ⷴӦ��ƽ�ⳣ��Kh��______mol��L��1������NaHSO3��Һ�м���������I2������Һ��![]() ��________(���������С�����䡱)��
��________(���������С�����䡱)��
(2)�绯ѧ������

��ͼ��ʾ��Pt(1)�缫�ķ�ӦʽΪ_________�����������£���Pt(2)�缫�ų���S2O42-��Һ����NO2��ʹ��ת��ΪN2��ͬʱ��SO32-���ɡ�������ת�Ƶ���6mol���������ϴ���NO2����____mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���OH�� �� CO32�� �� AlO2�� �� SiO32�� �� SO42�� �� K + �� Na + �� Fe3 + �� Mg2 + �� Al3 + �����ӣ�������Һ����μ���һ�����ʵ���������ʱ�����ɳ������ʵ����������������Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����
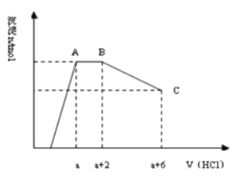
A��ԭ��Һ��һ������Na2SO4
B����Ӧ���γɵ���Һ����ΪNaCl
C��ԭ��Һ�к���CO32����AlO2�������ʵ�����Ϊ3��4
D��ԭ��Һ��һ�����е�������OH����CO32����SiO32����AlO2����K +
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com