
����Ŀ��N-������������ ![]() �㷺Ӧ����ҩ����ɱ�����
�㷺Ӧ����ҩ����ɱ�����![]() �뱽��
�뱽�� ![]() ��Ӧ�Ƶã�����ԭ�ϻ��Եͣ��ɲ��ù轺���������ȵķ�ʽ����ֱ�������ڷ��ӣ��ٽ����Բ�λ���ѣ��ɽ��ͷ�Ӧ�¶ȡ�ȡ�ôֲ�Ʒ��ϴ��-�ؽᾧ�ȣ����յõ����Ƶij�Ʒ����֪��
��Ӧ�Ƶã�����ԭ�ϻ��Եͣ��ɲ��ù轺���������ȵķ�ʽ����ֱ�������ڷ��ӣ��ٽ����Բ�λ���ѣ��ɽ��ͷ�Ӧ�¶ȡ�ȡ�ôֲ�Ʒ��ϴ��-�ؽᾧ�ȣ����յõ����Ƶij�Ʒ����֪��
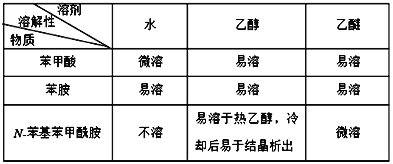
����˵������ȷ����
A. ��Ӧʱ�ϼ�λ��ΪC-O����N-H�� B. �����ܼ��ٸ÷�Ӧ����ЧӦ
C. �����ѡ���Ҵ���Ϊ�ܼ������ؽᾧ�ᴿ D. �轺��ˮ����ʹ��Ӧ���и���ȫ
 Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ĺ����������ͬ���˵������ͬ�������ǿ����ǣ��� ��
A. ���ֲ�ͬ������ B. ����Ԫ�صIJ�ͬԭ��
C. ͬ��Ԫ�ص�ԭ�Ӻ����� D. ���ֲ�ͬԪ�صķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ�������Ļ���������ܱ������ڷ�����ӦaA(g)+bB(g) ![]() cC��s��+dD(g)���ﵽƽ��ʱ���B�����Ũ��Ϊ0.6 mol��L��1�������½��ܱ��������ݻ�����һ�������´ﵽƽ��ʱ���������B�����Ũ��Ϊ0.4 mol��L��1������������ȷ����
cC��s��+dD(g)���ﵽƽ��ʱ���B�����Ũ��Ϊ0.6 mol��L��1�������½��ܱ��������ݻ�����һ�������´ﵽƽ��ʱ���������B�����Ũ��Ϊ0.4 mol��L��1������������ȷ����
A. a+b>c+d B. ƽ�������ƶ�
C. ���´�ƽ�⣬A����Ũ������ D. ���´�ƽ��ʱ��B�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ά��ͨ�����������(NH4CNO)�õ����أ������˹��ϳɵĵ�һ���л���Ӷ��ҿ����л��ϳɵ���Ļ�������ʷ���ĽǶȿ������������(����)
A.��B.��C.��D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֻ���������Mg(HSO3)2����Al(OH)3 ��Na[Al(OH)4]�� ��(NH4)2CO3����Al2O3���������NaOH��Һ����Ӧ����
A. �ڢ� B. �٢ڢ� C. �٢ڢܢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӧʱ���Ͽ�1molH2�л�ѧ�����ĵ�����ΪA���Ͽ�1mol O2�л�ѧ�����ĵ�����ΪB���γ�1molˮ�еĻ�ѧ���ͷŵ�����ΪC�������й�ϵ��ȷ����
A. A + B > CB. A + B < C
C. 2A + B < 2CD. 2A + B > 2C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ��ˮ������������(����)
A.Cl2+H2O�THCl+HClOB.2F2+2H2O�T4HF+O2
C.2Na+2H2O�T2NaOH+H2��D.CaO+H2O�TCa(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mL�Ȼ�þ���Ȼ����Ļ��Һ�У�Mg2+�����ʵ���Ũ��Ϊ0.2mol��L1��Cl�����ʵ���Ũ��Ϊ1.3mol��L1��ҪʹMg2+ȫ��ת��Ϊ�������������������Ҫ����4mol��L1NaOH��Һ�����Ϊ�� ��
A. 40mLB. 72mLC. 80mLD. 128mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���᳧�����¼��ַ�������SO2β����
(1)�����������շ�
�� Na2SO3��Һ����SO2�����ӷ���ʽΪ_______________����������Һ������Ũ���ɴ�С������˳��Ϊ______________��
�� �����£���������pH=6ʱ������Һ���������Ũ�ȹ�ϵһ����ȷ����_______
(�����)
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-��+C(H2SO3)
c.c(Na+)>c(SO32-)>c(OHһ)>c(H+)
d.ˮ�����c(OHһ)=1��l0-8mol/L
��25 ��ʱ��H2SO3![]() HSO
HSO![]() ��H���ĵ��볣��Ka��1��10��2mol��L��1������¶���NaHSO3ˮ�ⷴӦ��ƽ�ⳣ��Kh��______mol��L��1������NaHSO3��Һ�м���������I2������Һ��
��H���ĵ��볣��Ka��1��10��2mol��L��1������¶���NaHSO3ˮ�ⷴӦ��ƽ�ⳣ��Kh��______mol��L��1������NaHSO3��Һ�м���������I2������Һ��![]() ��________(���������С�����䡱)��
��________(���������С�����䡱)��
(2)�绯ѧ������

��ͼ��ʾ��Pt(1)�缫�ķ�ӦʽΪ_________�����������£���Pt(2)�缫�ų���S2O42-��Һ����NO2��ʹ��ת��ΪN2��ͬʱ��SO32-���ɡ�������ת�Ƶ���6mol���������ϴ���NO2����____mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com