

 +(2n-1)H2O.
+(2n-1)H2O. .
.
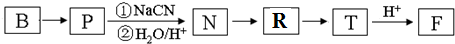
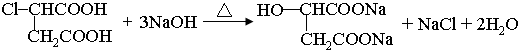 .
. 分析 有机物X的分子式为C13H14O8,在碱性条件下水解得到A、B、C,可推知X中含有酯基,E、F、G、H、X都能与NaHCO3溶液反应生成CO2,均含有羧基,A与酸反应得到E,E遇FeCl3溶液显紫色反应,说明X中含有苯环和酚羟基,结合G、H的分子式可知E分子中碳原子数目为7,分子内有4种不同环境的氢,且个数比为1:1:2:2,则E为 ,A为
,A为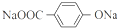 .C与酸化得到F,可知C中含有羧酸形成的钠盐结构,则B为醇.有机物X的不饱和度为(2×13+2-14)÷2=7,可判断X分子含有苯环、两个酯基外,还含有1个双键,1molG和H分别与足量NaHCO3反应消耗NaHCO3的物质的量相同,其中H无支链且能使溴水褪色,G的分子式为C2H2O4,且是B的氧化产物,所以B为HOCH2CH2OH,G为HOOC-COOH,F的结构简式为
.C与酸化得到F,可知C中含有羧酸形成的钠盐结构,则B为醇.有机物X的不饱和度为(2×13+2-14)÷2=7,可判断X分子含有苯环、两个酯基外,还含有1个双键,1molG和H分别与足量NaHCO3反应消耗NaHCO3的物质的量相同,其中H无支链且能使溴水褪色,G的分子式为C2H2O4,且是B的氧化产物,所以B为HOCH2CH2OH,G为HOOC-COOH,F的结构简式为 ,H为HOOCCH=CHCOOH,C为NaOOCCH2CH(OH)COOONa,
,H为HOOCCH=CHCOOH,C为NaOOCCH2CH(OH)COOONa,
若X不与Fe3+显紫色,说明X没有酚羟基,可知X为 .
.
(4)B转化P可以是乙醇发生取代反应生成BrCH2CH2Br,再与NaCN发生取代反应生成N为NC-CH2CH2-CN、水解生成N为HOOC-CH2CH2-COOH,N与氯气发生取代反应生成R为 ,R在氢氧化钠溶液、加热条件下发生水解反应生成T为NaOOCCH2CH(OH)COOONa,最后酸化得到F.
,R在氢氧化钠溶液、加热条件下发生水解反应生成T为NaOOCCH2CH(OH)COOONa,最后酸化得到F.
解答 解:有机物X的分子式为C13H14O8,在碱性条件下水解得到A、B、C,可推知X中含有酯基,E、F、G、H、X都能与NaHCO3溶液反应生成CO2,均含有羧基,A与酸反应得到E,E遇FeCl3溶液显紫色反应,说明X中含有苯环和酚羟基,结合G、H的分子式可知E分子中碳原子数目为7,分子内有4种不同环境的氢,且个数比为1:1:2:2,则E为 ,A为
,A为 .C与酸化得到F,可知C中含有羧酸形成的钠盐结构,则B为醇.有机物X的不饱和度为(2×13+2-14)÷2=7,可判断X分子含有苯环、两个酯基外,还含有1个双键,1molG和H分别与足量NaHCO3反应消耗NaHCO3的物质的量相同,其中H无支链且能使溴水褪色,G的分子式为C2H2O4,且是B的氧化产物,所以B为HOCH2CH2OH,G为HOOC-COOH,F的结构简式为
.C与酸化得到F,可知C中含有羧酸形成的钠盐结构,则B为醇.有机物X的不饱和度为(2×13+2-14)÷2=7,可判断X分子含有苯环、两个酯基外,还含有1个双键,1molG和H分别与足量NaHCO3反应消耗NaHCO3的物质的量相同,其中H无支链且能使溴水褪色,G的分子式为C2H2O4,且是B的氧化产物,所以B为HOCH2CH2OH,G为HOOC-COOH,F的结构简式为 ,H为HOOCCH=CHCOOH,C为NaOOCCH2CH(OH)COOONa,
,H为HOOCCH=CHCOOH,C为NaOOCCH2CH(OH)COOONa,
若X不与Fe3+显紫色,说明X没有酚羟基,可知X为 .
.
(1)有机物B为HOCH2CH2OH,名称是乙二醇,故答案为:乙二醇;
(2)B与G反应可生成高分子化合物M,其化学方程式是:n HOOC-COOH+n HOCH2CH2OH$\stackrel{催化剂}{→}$ +(2n-1)H2O,
+(2n-1)H2O,
故答案为:n HOOC-COOH+n HOCH2CH2OH$\stackrel{催化剂}{→}$ +(2n-1)H2O;
+(2n-1)H2O;
(3)若X不与Fe3+显紫色,由上述分析可知X可能的结构简式是: ,
,
故答案为: ;
;
(4)B转化P可以是乙醇发生取代反应生成BrCH2CH2Br,再与NaCN发生取代反应生成N为NC-CH2CH2-CN、水解生成N为HOOC-CH2CH2-COOH,N与氯气发生取代反应生成R为 ,R在氢氧化钠溶液、加热条件下发生水解反应生成T为NaOOCCH2CH(OH)COOONa,最后酸化得到F.
,R在氢氧化钠溶液、加热条件下发生水解反应生成T为NaOOCCH2CH(OH)COOONa,最后酸化得到F.
N→R的反应类型是:取代反应,R→T的化学方程式是: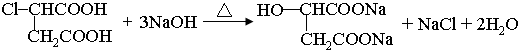 ,
,
故答案为:取代反应;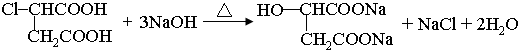 .
.
点评 本题考查有机物的推断与合成,结合有机物的分子式与性质综合分析,需要学生熟练掌握官能团性质与转化,较好的考查学生分析推理能力,难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 | |
| B. | 一种透明液体中加入电解质溶液,若有沉淀生成,则该液体不一定是胶体 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 放电影时,放映室射到银幕上的光柱是由胶粒对光的散射形成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入少量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →
→
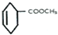
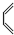 +
+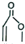 →
→
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将亚硫酸钡加入到盐酸中:SO${\;}_{3}^{2-}$+2H+=SO2↑+H2O | |
| B. | 金属钾与水反应:K+H2O=K++OH-+H2↑ | |
| C. | 向稀硝酸中加入少量铜屑:Cu+4H++NO-3=Cu2++2H2O+NO↑ | |
| D. | 向偏铝酸钠溶液中通过量CO2:AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
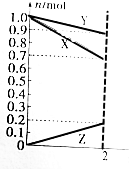 某温度时,在2L的容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为Y+3X=2Z.反应开始至2min,用Z表示的平均反应速率为0.05mol/(L.min).
某温度时,在2L的容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为Y+3X=2Z.反应开始至2min,用Z表示的平均反应速率为0.05mol/(L.min).查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
下列关于能源和作为能源的物质叙述错误的是( )
A.化石能源物质内部蕴涵着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同的条件下转化为热能、电能被人类利用
D.吸热反应没有利用价值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com