


科目:高中化学 来源: 题型:
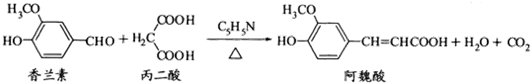
| A、香兰素、阿魏酸均可与溴水反应,且反应类型完全相同 |
| B、香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应 |
| C、与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种 |
| D、通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| Sb2O5 |
| H2 |
| Ni |

| 酶 |
| 酶 |
| ①H50Na |
| ②CH3Br |
| ①C2H5ONa |
| ②CH3CH2Br |
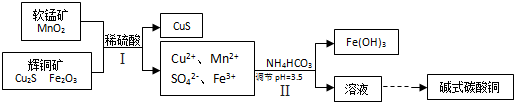
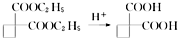 ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.| 反应物 |
| 反应条件 |
| 反应物 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
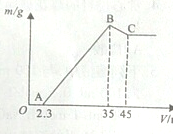 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题:
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
| c(NO2) |
| c(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )称为酰基.傅-克酰基化反应、脱氢反应在合成稠环芳烃时起着很大的作用.萘、蒽、菲等稠环芳烃的合成均可说明这些反应的普遍性.
)称为酰基.傅-克酰基化反应、脱氢反应在合成稠环芳烃时起着很大的作用.萘、蒽、菲等稠环芳烃的合成均可说明这些反应的普遍性.
 .
. .则在流程I中,有机物W的名称为
.则在流程I中,有机物W的名称为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com