
【题目】下列说法正确的是
A. 正丁烷和异丁烷均有两种一氯取代物
B. 乙烯和苯都能与H2发生加成反应,说明二者的分子中均含碳碳双键
C. 乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应更剧烈
D. 乙醛能被还原成乙醇,但不能被氧化成乙酸
科目:高中化学 来源: 题型:
【题目】下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的Na、K分别投入足量的同浓度、同体积的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中不正确的是

A. 曲线a对应的反应使用了催化剂
B. 投入的Na、K物质的量相等
C. 曲线a代表K的反应,曲线b代表Na的反应
D. 两反应中反应速率不同的主要原因是反应物自身的性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
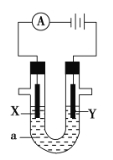
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
①电解池中Y电极上的电极反应式为 。在Y电极附近观察到的实验现象是 ;检验该电极反应产物的方法是 。
②X电极上的电极反应式为 。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:
①X电极的材料是 ,电极反应式为 ;
②Y极的材料是 ,电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应H2(g)+Cl2(g)═2HCl(g) 的发生过程能量变化如下所示:
![]()
下列说法错误的是
A.H﹣H键比Cl﹣Cl键稳定
B.△H=﹣184.5 kJmol﹣1
C.正反应活化能比逆反应活化能高
D.在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+ H2O![]() 2H++ 2CrO42-(黄色)①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+=2Cr3+(绿色) + 6Fe3+ + 7H2O。
2H++ 2CrO42-(黄色)①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+=2Cr3+(绿色) + 6Fe3+ + 7H2O。
下列分析正确的是
A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B.实验②能说明氧化性:Cr2O72-> Fe3+
C.CrO42-和Fe2+在酸性溶液中可以大量共存
D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脂肪、淀粉、蛋白质是三种重要的营养成分,其中 不是高分子化合物,它们都能发生_____________________反应,脂肪的产物是 ,淀粉的最终产物是_________________,蛋白质的最终产物是_____________,提纯蛋白质可以用的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)中和热的测定是高中重要的定量实验。取0.55 mol/L的NaOH溶液50 mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
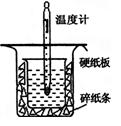
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________ _,除此之外,装置中的一个明显错误是 。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值会_________,(填“偏大”、“偏小”或“不变”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),简述理由: 。
(4)某实验小组用盐酸和氢氧化钠溶液做了三次实验,每次取溶液各50 mL,并记录下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),根据计算结果,写出该中和反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com