
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol?L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
A、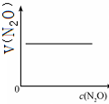 |
B、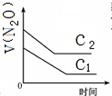 |
C、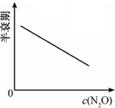 |
D、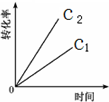 |


科目:高中化学 来源: 题型:
| A、①④⑥ | B、①③⑤ |
| C、①③⑤⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
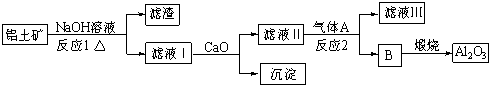
查看答案和解析>>
科目:高中化学 来源: 题型:
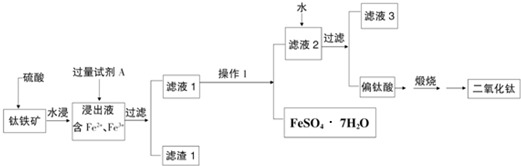
查看答案和解析>>
科目:高中化学 来源: 题型:
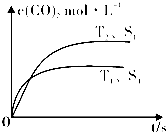 2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.| 催化剂 |
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
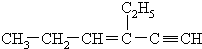 ,分子中含有四面体结构的碳原子数为a,在同一
,分子中含有四面体结构的碳原子数为a,在同一| A、4,3,5 |
| B、4,3,6 |
| C、2,5,4 |
| D、4,6,4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
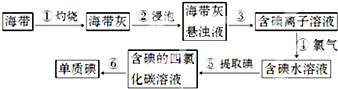
查看答案和解析>>
科目:高中化学 来源: 题型:
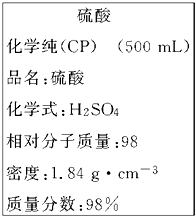 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol?L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol?L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com