
【题目】下列式子属于水解反应,且溶液呈酸性的是 ( )
A.HCO3- + H2O ![]() H3O+ + CO32-
H3O+ + CO32-
B.Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C.HS- + H2O ![]() H2S + OH-
H2S + OH-
D.NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )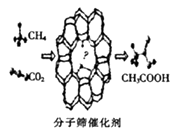
A.消耗22.4 LCO2可制得1mol乙酸
B.该反应过程符合“绿色化学”原理,其原子利用率为100%
C.该反应属于取代反应
D.反应物和生成物中均含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4 7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH 为3.0,沉淀完全时的pH为5.5:
回答下列问题:
(1)操作Ⅱ中用硫酸酸化至pH=2且通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②;
(2)操作IV的顺序依次为:、、过滤、洗涤。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②。
(4)测定绿矾产品中Fe2+ 含量的方法是:a.称取8.680g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.02000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为30.00 mL(滴定时发生反应的离子方程式为:5Fe2+ + MnO4- + 8H+ ═ 5Fe3+ + Mn2+ + 4H2O)
①计算上述样品中FeSO4 7H2O的质量分数为(结果保留4位有效数字,FeSO4 7H2O的摩尔质量为278g/mol)
②若用上述方法测定的样品中FeSO47H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有:样品中存在少量的杂质、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2 , 加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.0lmol/L CH3COOH 溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是
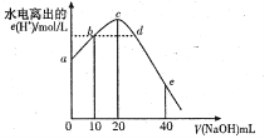
A. 从a到c,醋酸的电离始终受到促进
B. b、d两点溶液的pH相同
C. c点所示溶液中c(Na+)>c(CH3COO- )>c(OH- )>c(H+ )
D. e 点所示溶液中,c(Na+)=2c(CH3COO- )+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水中加入等物质的量的Ag+、Pb2+、Na+、SO42﹣、NO3﹣、Cl﹣ , 该溶液放在用惰性材料做电极的电解槽中,通电片刻后,则氧化产物与还原产物的质量之比为( )
A.35.5:108
B.16:207
C.8:1
D.108:35.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com