
| A、+2 | B、+3 | C、+4 | D、+5 |


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
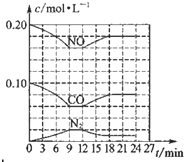 将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0在不同条件下,反应过程中部分物质的浓度变化如图所示.下列说法正确的是( )
将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0在不同条件下,反应过程中部分物质的浓度变化如图所示.下列说法正确的是( )| A、容器内的压强不发生变化说明该反应达到平衡 |
| B、当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C、第12 min时改变的反应条件为减小压强 |
| D、向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
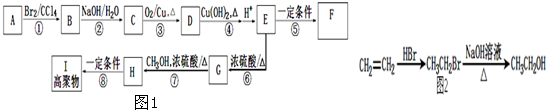
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量 |
| B、将NaOH溶液逐滴滴入AlCl3溶液中,直至过量 |
| C、向AlCl3溶液中逐滴滴入稀硫酸 |
| D、将氨水逐滴滴入硝酸银溶液中,直至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| HCl |
| 实 验 序 号 | 初始浓度c/mol?L-1 | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.0010 | 290 |
| ② | 1.60 | 0.20 | 0.0010 | 145 |
| ③ | 0.80 | 0.40 | 0.0010 | 145 |
| ④ | 0.80 | 0.20 | 0.0020 | 580 |
| A、增大c(Br2),v(Br2)增大 |
| B、实验②和③的v(Br2)相 |
| C、增c(HCl),v(Br2)增大 |
| D、增大c(CH3COCH3),v(Br2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,物质的物质的量相等,其体积一定相同 |
| B、等体积的二氧化碳和一氧化碳所含的分子数一定相等 |
| C、1L氮气一定比1L氧气的质量小 |
| D、相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ABCDE |
| B、CDABE |
| C、BADCE |
| D、ECDBA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.第二周期ⅤA族 |
| B、.第三周期ⅣA族 |
| C、.第二周期ⅥA族 |
| D、.第三周期Ⅶ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
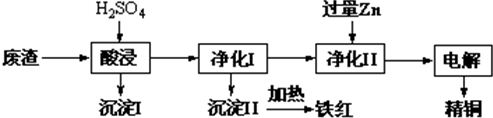
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com