
【题目】将一定量的Fe、Fe2O3和CuO的混合物,放入体积为100 mL物质的量浓度为2.2 mol/L的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28 g。过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL)。向滤液中加入2 mol/L NaOH溶液至40mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为
A. 1.8 mol/LB. 2 mol/LC. 2.2 mol/LD. 无法计算
【答案】A
【解析】
Fe、Fe2O3和CuO的混合物放入H2SO4溶液中充分反应后过滤,滤液中的金属离子只有Fe2+,发生的反应有Fe+H2SO4=FeSO4+H2↑、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、CuO+H2SO4=CuSO4+H2O、Fe+ Fe2(SO4)3=3FeSO4、Fe+CuSO4=FeSO4+Cu;滤液中加入2mol/LNaOH溶液至40mL时开始出现沉淀,说明与混合物反应后硫酸过量,所得滤液中含H2SO4和FeSO4,过量的硫酸物质的量为![]() ×2mol/L×0.04L=0.04mol;根据SO42-守恒,n(FeSO4)=2.2mol/L×0.1L-0.04mol=0.18mol,未滴加NaOH溶液前滤液中FeSO4物质的量浓度为0.18mol÷0.1L=1.8mol/L,答案选A。
×2mol/L×0.04L=0.04mol;根据SO42-守恒,n(FeSO4)=2.2mol/L×0.1L-0.04mol=0.18mol,未滴加NaOH溶液前滤液中FeSO4物质的量浓度为0.18mol÷0.1L=1.8mol/L,答案选A。


科目:高中化学 来源: 题型:
【题目】在25℃时,向l0mL0.01mol·L-1NaA溶液中逐滴加入0.01mol·L-1的盐酸,滴定曲线如下图所示,下列说法正确的是( )

A. a点到c点的过程中,c(HA)+c(A-)=0.01mol·L-1等式始终成立
B. b点时,溶液中微粒浓度大小的关系:c(A-)>c(Cl-)>c(HA)>c(OH-)>c(H+)
C. c点溶液存在的关系:c(Na+)+c(H+)=c(HA)+c(OH-)+2c(A-)
D. 由图可知,等浓度的HA、NaA混合溶液中,HA的电离程度大于A-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1.0 mol NaCl固体中含有NA个NaCl分子
B. 1 mol OH—和1mol—OH(羟基)中含有的质子数均为9NA
C. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
D. 1L0.2molL—1的NaHCO3溶液中HCO3—和CO32—离子数之和为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项说法正确的是
A. 可以直接加热的仪器有:坩埚、 烧杯、试管 、蒸发皿 。
B. 量筒的“0”刻度位置在在量筒的上端 ,托盘天平的“0”刻度在托盘天平标尺的正中。
C. 用如图所示装置进行实验: 从B口进气,用排空气法收集CO2 ;瓶中装满水,从B口进气,用排水法收集NO2。

D. 常见残留物的洗涤方法如容器壁上附着的硫 ,可用CS2或热的NaOH溶液洗涤,试管壁上附着AgCl ,可用氨水洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJmol1,
2H2(g)+O2(g)═2H2O(g) △H=484kJmol1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)![]() CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,则该溶液的溶质的物质的量浓度为______。
(2)在11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每1molCuSO4可以氧化磷的物质的量是______。
(3)两个同容积的密封容器A、B,常温下,A中充入agA气体,B中充入agCH4气体,A与B内的压强之比是4:11,则A的摩尔质量为______。
(4)20mLCaCl2溶液加水稀释至100mL,稀释后的溶液中Cl-离子的物质的量浓度为1mol/L,则稀释前CaCl2的物质的量浓度为______。
(5)在一定温度和压强下,3L气体A2跟9L体积的气体B2完全化合生成6L体积某气体C,则该气体C的化学式为(用A、B表示)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物 的系统命名是________________________________________________________________________,
的系统命名是________________________________________________________________________,
将其在催化剂存在下完全氢化,所得烷烃的系统命名是________________________________________________________________________。
(2)有机物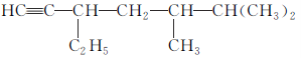 的系统命名是________________________________________________________________________,
的系统命名是________________________________________________________________________,
将其在催化剂存在下完全氢化,所得烷烃的系统命名是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com