
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](C104)2}是一种新型的起爆药。
(1)Ni2+核外电子排布式为___。
(2)ClO4-空间构型是___;与ClO4-互为等电子体的一种分子为___(填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为___;C、N、O三种元素的电负性由大到小的顺序为___。
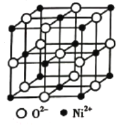
(4)高氯酸三碳酰肼合镍可由NiO、髙氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为___。
【答案】[Ar]3d8或1s22s22p63s23p63d8 正四面体 CCl4(或SiF4等) sp2 O>N>C 4
【解析】
(1)基态镍原子有28个电子,其原子核外有2个未成对电子,镍原子失去最外层两个电子生成二价镍离子,根据构造原理书写二价镍离子核外电子排布式;
(2)计算Cl原子价层电子对数、孤电子对,进而确定ClO4-的空间构型;原子总数相同、价电子总数相同的微粒互为等电子体;
(3)CO(N2H3)2中C原子与O原子之间形成双键,与N原子之间形成C-N单键,没有孤对电子,据此确定杂化轨道数目,进而确定杂化方式;同周期自左而右电负性增大,据此规律进行分析;
(4) 利用均摊法进行晶胞中粒子数目的分析。
(1)Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,3d能级有2个未成对的电子,Ni失去4s能级2个电子形成Ni2+,Ni2+离子核外电子排布式为: [Ar]3d8或1s22s22p63s23p63d8 ;
答案是: [Ar]3d8或1s22s22p63s23p63d8 ;
(2) ClO4-中氯原子价层电子对数为4+(7+1-2×4)/2=4、没有孤电子对,故其空间构型是正四面体;原子总数相同、价电子总数相同的微粒互为等电子体,与ClO4-互为等电子体的一种分子为CCl4(或SiF4等);
故答案是:正四面体;CCl4(或SiF4等);
(3)CO(N2H3)2中C原子与O原子之间形成双键,与N原子之间形成C-N单键,没有孤对电子,杂化轨道数目为3,C原子采取sp2 杂化;同周期自左而右电负性增大,故电负性: O>N>C;
故答案是:sp2;O>N>C;
(4) Ni2+离子位于晶胞顶点及面心,晶胞中Ni2+数目x=8×1/8+6×1/2=4;
故答案是:4。


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图(I)所示。保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示。下列结论正确的是( )
图(I)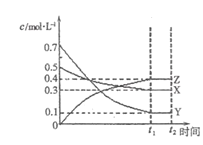 图(Ⅱ)
图(Ⅱ)
A.图(Ⅱ)中T1>T2,则正反应是吸热反应
B.t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大
D.T℃时,若密闭容器中各物质起始浓度为:0.4 mol/L X、0.4 mol/L Y、0.2 mol/L Z,保持其他条件不变,达到平衡时Z的浓度为0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内的血红蛋白(Hb)和肌红蛋白(Mb)均可与O2结合,Hb也可以与CO结合。
已知:反应①:Hb(aq)+O2(g)![]() HbO2(aq) H1<0;
HbO2(aq) H1<0;
反应②:Hb(aq)+CO(g)![]() HbCO(aq) H2<0
HbCO(aq) H2<0
反应③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) H3
HbCO(aq)+O2(g) H3
(1)H3=_____(用H1、H2表示);反应③自发进行的趋势较大,则H1_____H2(填“>”、“<”或“=”)
(2)CO中毒者应立即转移至空气新鲜的地方,结合反应③,从平衡移动的原理分析这样做的理由是_____。
(3)肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g) ![]() MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,则解毒时提供病人呼吸的O2的压强是__________。
②该反应平衡总数的表达式为![]() ,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。
,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。

③ T℃时,![]() kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里研究不同价态硫元素之间的转化
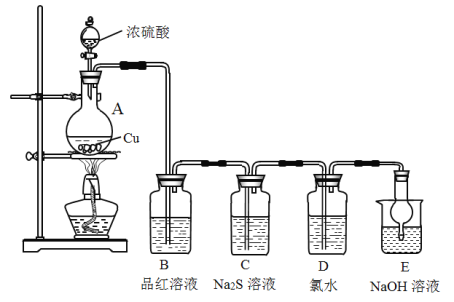
(1)A中发生反应的化学方程式为__________。
(2)B中的现象是__________。
(3)C中的现象是__________,Na2S在反应中做__________剂。
(4)D中氯水褪色,此反应中硫元素的化合价由_____转化为______;甲认为可以补充一个实验进一步证明硫元素的价态转化,实验方案和现象为:取D中褪色后的溶液于试管中________。
(5)E的作用是__________,离子方程式为__________。
(6)上述实验体现SO2的性质有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 依据铝热反应原理,能发生反应2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
B. 在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32-、Cl-一定能够大量共存
C. 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D. 氯化铝溶液中加入过量氨水反应实质是:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)主要用作火箭和喷气发动机燃料。
(1) 已知 ① 2O2(g)+N2(g) === N2O4(l) ΔH=a kJ·mol-1
② N2(g)+2H2(g) === N2H4(l) ΔH=b kJ·mol-1
③ 2H2(g) + O2(g) = 2H2O(g) ΔH=c kJ·mol-1
某型号火箭采用液态肼和液态N2O4作推进剂,燃烧生成两种无污染的气体。写出反应的热化学方程式____。偏二甲肼(1,1-二甲基肼)也是一种高能燃料,写出其结构简式______。
(2)肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的化学方程式________,理论上,每消耗64 g肼可除去标准状况下O2________L
(3)科学家用肼作为燃料电池的燃料,电池结构如图1所示,

写出电池负极的电极反应式:________。
(4)N2H4在特定条件下(303K,Pt,Ni作催化剂)可以发生部分分解:N2H4(g) ![]() 2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=________。
2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温常压下,32 g氧气所含的原子数为NA
B.标准状况下,22.4 L 四氯化碳的分子数为NA
C.0℃,101 kPa下,44.8 L氮气所含有的分子数为2NA
D.常温常压下,1 mol氦气含有的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
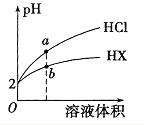
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com