
【题目】(1)相同温度下等物浓度的下列溶液中,A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
① pH值由大到小的顺序是___________________(用对应的字母填写)。
② NH4+离子浓度由大到小的顺序是___________________(用对应的字母填写)。
(2)25℃向50 mL 0.018 mol·L-1 的 AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。己知该温度下AgCl的Ksp =l.0×l0-10,忽略溶液的体积变化,请计算:
① 完全沉淀后,溶液中c(Ag+)=_____________。
② 完全沉淀后,溶液的pH=____________。
(3)弱酸及其盐在水中存在多种平衡关系。己知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
① 己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为___________________。
② 向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =________。
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1 Fe3+和0.26 mol·L-1 Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5 mol·L-1 ]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2 = 2.6×l0-19;KspFe(OH)3 = 4×l0-38]
【答案】 B、A、D、C D、C、A、B 1.0×10-7 mol/L 2 c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-) 0.08mol 3 ≤pH≤5
【解析】(1)A.铵根离子水解,溶液呈酸性;B.碳酸氢根离子促进铵根离子水解,酸性较氯化铵溶液酸性弱;C.电离出氢离子,并抑制铵根离子水解,显强酸性;D.铵根离子水解,水解程度不大,铵根离子浓度最大,酸性比氯化铵溶液的酸性强,但是比硫酸氢铵的酸性弱。
①pH值由大到小的顺序是: B、A、D、C ,正确答案: B、A、D、C 。
②NH4+离子浓度由大到小的顺序是D、C、A、B ;正确答案D、C、A、B。
(2)①向50 mL 0.018 mol·L-1 的 AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸, 混合后两者浓度分别为c(Ag+)=0.018/2=0.009 mol·L-l、c(Cl-)=0.02/2=0.01mol·L-l,由于Ag+与Cl-为等物质的量反应,因此Cl-过量,浓度为c(Cl-)=0.01-0.009=0.001 mol·L-l,根据Ksp =l.0×l0-10,则c(Ag+)= l.0×l0-10/0.001=1.0×10-7 mol/L;正确答案:1.0×10-7 mol/L。
②沉淀生成后,氢离子浓度c=0.02/2=0.01 mol/L,所以溶液的pH=2;正确答案:2。
(3)①常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液,所得溶液中含有:0.05 molNaA、0.05molHA、0.05molNaCl;己知该混合溶液为弱酸性,同浓度溶液中HA电离大于![]() 离子的水解, c(A-) > c(Cl-)、c(H+) > c(OH-),则溶液中离子浓度大小为:c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-);正确答案:c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-)。
离子的水解, c(A-) > c(Cl-)、c(H+) > c(OH-),则溶液中离子浓度大小为:c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-);正确答案:c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-)。
②向该混合物中再加0.03mol NaOH,酸碱发生中和后,混合液中含有0.05molNaCl、0.08molNaA、0.02 molHA,根据混合液中电荷守恒可得:n(A-) +n(OH-)+ c(Cl-)= c(Na+)+ n(H+),则n(A-) +n(OH-)-n(H+) =c(Na+)-c(Cl-)=0.05+0.08-0.05=0.08 mol;正确答案:0.08 mol。
(4)根据![]() ,当
,当![]() 完全沉淀
完全沉淀![]() 时
时![]() ,此时溶液
,此时溶液![]() ,当
,当![]() 开始沉淀时,根据
开始沉淀时,根据![]() ,
,![]() ,此时溶液
,此时溶液![]() ,则需控制溶液
,则需控制溶液![]() 的范围为3 ≤pH≤5;正确答案:3 ≤pH≤5。
的范围为3 ≤pH≤5;正确答案:3 ≤pH≤5。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】取Na2CO3和NaHCO3的混合粉末样品22.1g,将其加热到质量不再改变,冷却后称固体质量为15.9g。则原混合物中Na2CO3的质量为
A. 4.2g B. 5.3g C. 8.4 g D. 10.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
请回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水_________。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大_______。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 B.定容时,俯视刻度线
C.定容时,仰视刻度线 D.移液时,有少量液体溅出
(3)若称取样品的质量为1.5g,共配制100mL的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol·L-1盐酸滴定,其用去盐酸的体积为23.0mL,则该样品中N的含量为________。
(滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3)
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 若c(SO2)与c(O2)之比为k,则:k甲=k丙>k乙
B. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
C. 容器内压强P:P甲=P丙>2P乙
D. SO3的质量m:m甲=m丙>2m乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某回学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)
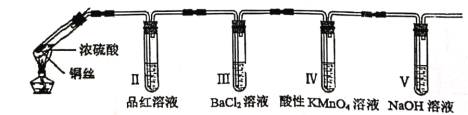
下列说法错误的是
A. 反应后,试管Ⅰ中出现白色固体,将其放入水中,溶液显蓝色
B. 试管Ⅱ中品红溶液逐渐褪色,对其加热溶液又恢复红色
C. 试管Ⅳ中高锰酸钾褪色,体现了SO2的漂白性
D. 试管Ⅴ可以改为装有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
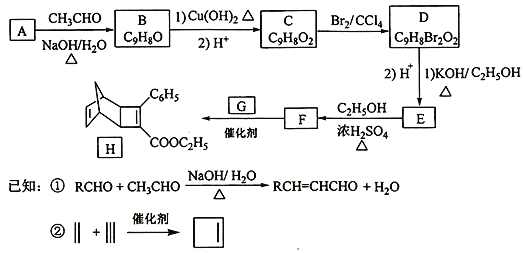
回答下列问题:
(1)A的化学名称为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物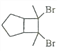 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的ΔH能表示物质燃烧热的是(假设数据均正确)
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=+1 367 kJ·mol-1
B. 2CO (g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
C. H2 (g)+1/2O2(g)= H2O(g ) ΔH=-285.8 kJ·mol-1
D. S(s)+O2(g)=SO2(g) ΔH=-296.95 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
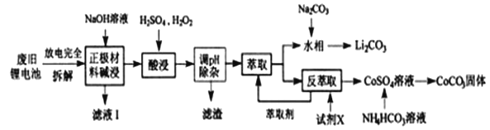
【题目】钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5mo/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)滤液I的主要成分是_________。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是________不能用盐酸代替硫酸,原因是:__________。“调节pH”除去的离子主要有Al3+和_____。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是_________。
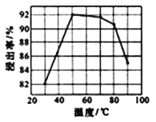
(4)“萃取”和“反萃取“可简单表示为:Co2++2(HA)2![]() Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com